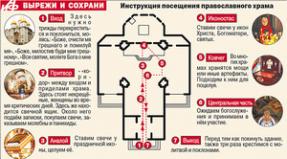
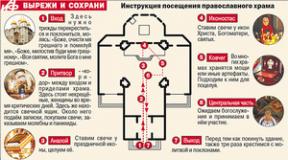
Вирусный гепатит В. Этиология, эпидемиология, клиника, лечение
Для составления ответов использовалась нормативная документация Российской Федерации и международные рекомендации.
Профилактика гепатита В – не тема для заочной консультации. Наилучшее решение – обращение к очному специалисту.
Какими документами регламентирована в России вакцинация против гепатита В?
Приказ Минздрава РФ от 21 марта 2014 г. N 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»
Инструкции по применению конкретных наименований вакцин против гепатита В.
Как производятся рекомбинантные вакцины против гепатита В?
Рекомбинантные вакцины, зарегистрированные в РФ, производятся с применением культуры пекарских дрожжевых грибков, в которую добавляются плазмиды, содержащие поверхностный антиген вируса гепатита В (HBsAg). Делясь, клетки дрожжей увеличивают количество этого антигена. Очищенный HBsAg получается разрушением клеток дрожжей и отделением HBsAg от компонентов дрожжей биохимическими и биофизическими методами.
Лица с установленной тяжелой аллергией на пекарские дрожжи не должны прививаться вакцинами, произведенными с применением культуры дрожжей.
Защищают ли вакцины против гепатита В (например, зарубежного производства) от разновидностей вируса, циркулирующего именно в России?
Вакцины на основе рекомбинантного HBsAg защищают от всех (в настоящее время известно шесть) разновидностей вируса гепатита В, включая те из них, которые распространены в России.
Как долго защищает вакцинация против гепатита В? Нужна ли ревакцинация?
Исследования показали, что вакцинация (введение трех доз вакцины), проведенная в течение раннего детства, может создать долговременную защиту от носительства вируса, Исследования также показали эффективность первичного курса вакцинации против гепатита В в предотвращении возникновения инфекции в течение 22 лет после вакцинации, проведенной во младенчестве (в течение этого срока применяется рекомбинантная вакцина против гепатита В в мире). Нет убедительных доказательств для рекомендации внедрения в практику ревакцинации против гепатита В в рамках плановой иммунизации. В Календаре прививок различных стран, в том числе в РФ, рекомендации по плановой ревакцинации против гепатита В отсутствуют.
Почему есть защита даже при отсутствии защитного титра антител?
Снижение уровня анти-HBsAg антител не является подходящим критерием для решения вопроса о необходимости проведения ревакцинации. Как показали исследования, иммунологическая память сохраняется и дает адекватный ответ на повторное введение антигена. Эффективность защиты против инфицирования ВГВ снижается в подростковом возрасте (прим. - при вакцинации в младенчестве ), но эффективность в отношении хронизации этой инфекции и развития заболевания остается высокой, такие случаи регистрируются редко.
Источник – «Еженедельные документы по эпидемиологии ВОЗ» («Weekly epidemiological record»), выпуск 5 июня 2009 (84), стр. 228-230, www.who.int/wer . «Совещание Консультативной группы экспертов по разработке стратегии в области иммунизации, апрель 2009 года. Выводы и рекомендации.»
Безопасна ли вакцина против гепатита В?
Да, безопасна. Вакцина против гепатита В безопасна при введении новорожденным, младенцам, детям, подросткам и взрослым. С 1986 года в мире и в экономически развитых странах привиты десятки миллионов детей и взрослых, это более миллиарда доз вакцины.
Побочные явления после введения вакцины против гепатита В наблюдаются редко и обычно в легкой форме. В контролируемых с использованием плацебо исследованиях, за исключением местных болевых ощущений, такие проявления как миалгия и преходящее повышение температуры, наблюдались не чаще, чем в группе получившей плацебо (менее 10% у детей и 30% у взрослых). В многочисленных долговременных исследованиях не получено фактов появления серьезных побочных реакций. Сообщения об анафилактических реакциях весьма редки.
Имеющиеся данные указывают на отсутствие причинной связи между вакциной против гепатита В и синдромом Гийена-Барре, демиелинизирующими расстройствами, рассеянным склерозом, синдромом хронической усталости, артритом, аутоиммунными расстройствами, астмой, синдромом внезапной смерти младенцев, диабетом. Международные эксперты подтверждают превосходную характеристику безопасности вакцины против гепатита В.
Можно ли заразиться от вакцины вирусом гепатита В? Заразен ли привитой?
Заразиться гепатитом В от вакцины невозможно. Вакцина содержит не цельный вирус гепатита В, а часть его внешней оболочки, которая не может вызвать гепатит даже теоретически а может лишь вызвать формирование иммунного ответа к ним. По этим же причинам привитой не является источником инфекции, нет никаких противопоказаний к донорству.
Желтуха новорожденных и вакцинация
Желтуха встречается у большинства (приблизительно от 40 до 70%) совершенно здоровых доношенных новорожденных и обычно является результатом естественных процессов, происходящих в его организме. Желтую окраску коже придает особое вещество - билирубин. Он содержится в крови каждого человека и выводится печенью. В период внутриутробной жизни билирубин плода выводится печенью матери. После рождения печень ребенка еще не в состоянии справиться с количеством билирубина, он постепенно накапливается в крови, и обычно только на 2-3 день это становится заметным по изменению окраски кожи ребенка - она приобретает желтоватый оттенок. Постепенно усиливаясь, желтуха становится максимально выраженной к 4-5 суткам и совершенно исчезает к 2-3 недельному возрасту безо всякого лечения (так называемая физиологическая желтуха).
Вакцинация против гепатита В не влияет на длительность и выраженность желтухи новорожденных, никак не влияет на функцию печени. Физиологическая желтуха новорожденных не является противопоказанием к проведению иммунизации.
Взаимозаменяемость рекомбинантных вакцин
Рекомбинантные вакцины против гепатита В, доступные на международном и российском рынке, иммунологически считаются сравнимыми и могут заменять друг друга.
Все ли вакцины от гепатита В имеют одинаковую основу?
Все рекомбинантные вакцины против гепатита В производятся с использованием культуры дрожжей и полностью взаимозаменяемы.
Первую прививку против гепатита B ребенку сделали в роддоме вакциной одного производителя. Вторую - вакциной другого производителя. Сейчас планируется 3-я вакцинацию, в наличии есть вакцина третьего производителя. Можно ли так прививаться разными вакцинами?
Можно использовать любую рекомбинантную вакцину против гепатита В, они взаимозаменяемы.
Какие вакцины против гепатита В зарегистрированы в РФ?
Вакцина против гепатита В имеется в виде моновакцины или в комбинации с другими вакцинами. В России на сегодняшний день зарегистрированы моновакцины и вакцины против гепатита В совместно с АКДС-вакцинами или вакциной АДС-М, а также комбинированная вакцина против гепатитов А и В.
Иммунные ответы и безопасность этих комбинаций сравнимы с таковыми в случае введения компонентов этих вакцин по отдельности.
Кто находится в группе особо повышенного риска инфицирования гепатитом В?
Сексуальные партнеры HBsAg-позитивных людей;
Сексуально активные люди, не находящиеся в долговременных моногамных отношениях;
Люди, имеющие (имевшие) заболевания, передающиеся половым путем;
Люди с вирусным гепатитом С (развитие гепатита В приводит к утяжелению патологии печени);
Люди с хроническими заболеваниями печени;
Люди, контактирующие в быту с HBsAg-позитивными людьми;
Медицинские и социальные работники, особенно контактирующие с кровью и биологическими жидкостями;
Персонал и жители социальных организаций для людей с нарушениями здоровья;
Люди с терминальной стадией заболевания почек, включая получающих диализ (гемодиализ, перитонеальный диализ);
Люди с ВИЧ-инфекцией;
Путешественники, выезжающие в регионы, где отмечается средний или высокий уровень инфекций, вызванных вирусом гепатита В;
Мужчины, имеющие сексуальные отношения с мужчинами;
Потребители инъекционных наркотиков.
Вакцина против гепатита В противопоказана только тем, у кого ранее наблюдались тяжелые аллергические реакции на предыдущие дозы вакцины против гепатита В или на компоненты этой вакцины (например, дрожжи).
Не являются противопоказанием
Ни беременность, ни лактация не являются противопоказанием для использования рекомбинантных вакцин против гепатита В. Как недоношенные младенцы, так и ВИЧ-позитивные люди могут быть привиты. Вакцинация против гепатита В не противопоказана лицам с рассеянным склерозом, синдром Гийена-Барре в анамнезе, при аутоиммунных заболеваниях (например, системная красная волчанка или ревматоидный артрит).
Можно ли бесплатно получить прививку против гепатита В и кому?
В соответствии с Национальным календарем профилактических прививок РФ в поликлиниках по месту жительства бесплатно (за счет государственного финансирования) можно привиться против гепатита В всем детям любого возраста и взрослым до 55 лет.
Подскажите, чем обусловлено в Календаре прививок РФ ограничение по возрасту (до 55 лет) для вакцинации взрослых против гепатита В? Возможна ли вакцинация в возрасте 85 лет?
Национальный календарь прививок РФ является также своего рода финансовой гарантией государства, где указывается, какие прививки в каком возрасте можно получить за счет государства. Таким образом, государство обеспечивает бесплатную вакцинацию против ГВ определенных групп людей. Остальные - за свой счет. Медицинских ограничений по возрасту для прививки против гепатита В нет.
Вакцинация против гепатита В и планирование беременности.
Мне осталась последняя третья вакцина против гепатита В. Я планирую беременность, через какое время после вакцинации можно уже не предохраняться?
Никаких отсрочек в наступлении беременности прививка против гепатита В не требует.
Мне сделали первую инъекцию против гепатита, но я собираюсь беременеть, можно ли, ведь мне еще предстоит сделать инъекцию через месяц и полгода?
В таком случае врач может порекомендовать сделать через 4 недели от первой прививки вторую прививку, а затем сразу планировать беременность. Две прививки уже обеспечивают довольно высокую защиту от гепатита В, а во время беременности Вы будете проходить довольно много медицинских обследований, после родов могут переливать кровь. Две прививки уже намного снизят риск инфицирования гепатитом В, а одна - нет. Третью прививку можно сделать сразу по окончании беременности, кормление грудью не является противопоказанием.
Планируем беременность, мужу сделали (планируют сделать) прививку против гепатита В. Нужно ли отложить планирование?
Никакого отношения вакцинация мужа любыми вакцинами, в том числе против гепатита В, к планированию беременности не имеет. Откладывать планирование из-за вакцинации мужа не нужно, на возникновение и течение беременности вакцинация мужа никак не влияет. Наоборот, привитой от инфекций муж представляет собой часть надежной защиты беременной и будущего младенца.
Вакцинация против гепатита В и беременность
В идеале к моменту наступления беременности женщина должна быть полностью вакцинирована. Хотя риск для плода при введении как инактивированных, так и живых вакцин строго не доказан, их применение может совпасть с рождением ребенка с врожденным дефектом, что создаст сложную для интерпретации ситуацию. В связи с этим ставить вопрос о вакцинации беременной следует лишь в особых случаях, например, при предстоящем переезде в эндемичную зону или при контакте с управляемой инфекцией, к которой женщина неиммунна. Беременность не является противопоказанием к вакцинации против гепатита В (.
Можно ли во время беременности сделать третью (последнюю) прививку от гепатита В?
Вакцины против ГВ являются инактивированными и не противопоказаны при беременности. Но, обычно, вакцинацию при беременности проводят в случае высокой опасности для беременной каких-либо инфекций (грипп, бешенство, столбняк и какие-то еще по усмотрению врача). Таким образом, если нет большой угрозы заражения с учетом имеющейся защиты от уже сделанных двух прививок против ГВ, можно рекомендовать сделать третью прививку после родов. Кормящим грудью можно прививаться любыми вакцинами без ограничений.
Вакцинация и кормление грудью
Кормление грудью не является противопоказанием к вакцинации женщины, вакцины против гепатита В не представляют угрозы для здоровья её и ребенка (Методические указания МУ 3.3.1.1123-02 "Мониторинг поствакцинальных осложнений и их профилактика" утв. Главным государственным санитарным врачом РФ 26 мая 2002 г )
Вакцинация лиц с острыми заболеваниями
Как и в случае вакцинации против других инфекций, введение прививки против гепатита В лицам во время острого заболевания или обострения хронического (с лихорадкой или без нее) должно быть отложено до выздоровления (купирования обострения).
Вакцинация лиц с хроническими заболеваниями
Вакцинация временно откладывается до купирования обострения. Как и в случае вакцинации против других инфекций, введение прививки лицам во время острого заболевания или обострения хронического (с лихорадкой или без нее) должно быть отложено до выздоровления (купирования обострения). Вне обострения вакцинацию можно проводить на фоне получаемого лечения.
Вакцинация детей с частыми ОРВИ
Нужно ли дожидаться окончания катаральных явлений после снижения температуры?
Частые ОРВИ не свидетельствуют о наличии "вторичного иммунодефицита" и не могут быть поводом для отвода от прививок. Прививки проводят вскоре (через 5-10 дней) после очередного ОРВИ, остаточные катаральные явления (насморк, кашель и др.) не являются препятствием к вакцинации. (Методические указания МУ 3.3.1.1123-02 "Мониторинг поствакцинальных осложнений и их профилактика" утв. Главным государственным санитарным врачом РФ 26 мая 2002 г .
Вакцинация против гепатита В и прием различных лекарств
В инструкциях по применению рекомбинантных вакцин против гепатита В не указано никаких лекарственных веществ, прием которых может послужить отводом для прививки.
График вакцинации против гепатита В в России
При начале вакцинации в родильном доме, дети из групп риска носителями вируса гепатита В (родившиеся от матерей - носителей HBsAg; больных вирусным гепатитом В или перенесших вирусный гепатит В в третьем триместре беременности; не имеющих результатов обследования на маркеры гепатита В; наркозависимых, в семьях, в которых есть носитель HBsAg или больной острым вирусным гепатитом В и хроническими вирусными гепатитами)
(схема 0-1-2-12)
Вторая прививка в 1 месяц
Третья прививка в 2 месяца
Четвертая прививка в 12 месяцев (можно одновременно с вакцинацией против кори-краснухи-паротита)
При начале вакцинации в родильном доме, дети рожденные от матерей, НЕ из ГРУПП РИСКА по гепатиту В
(схема 0-1-6 месяцев)
– первая прививка в течение первых суток после рождения,
Вторая прививка в возрасте 1 месяц
Третья прививка в 6 месяцев (обычно одновременно с третьей вакцинацией против дифтерии-столбняка-коклюша-полиомиелита)
Стандартная схема вакцинации для детей (не привитых в роддоме) и взрослых также 0-1-6 месяцев (где 0 – дата первой прививки, вторая прививка через месяц от первой, третья – через 6 месяцев от первой);
Стандартная схема для детей и взрослых, близко контактирующих с носителями вируса гепатита В – 0-1-2-12 месяцев.
Одновременное введение с другими вакцинами
В соответствии с рекомендациями Национального календаря профилактических прививок Российской Федерации допускается введение вакцин (кроме вакцин для профилактики туберкулеза), применяемых в рамках Национального календаря профилактических прививок, в один день разными шприцами в разные участки тела.
Международные рекомендации и рекомендации развитых стран гласят, что если вакцины не были введены одновременно, то интервал между введением различных инактивированных вакцин или инактивированной и живой вакцины может быть любым (« » ).
Таким образом, если вакцина против гепатита В не введена одновременно с другими вакцинами, то она (как инактивированная вакцина) может быть введена в любой день после предыдущей прививки, хоть на следующий день.
Так и поступают в родильных домах, где интервал между введением вакцины против гепатита В (при рождении) и вакцины БЦЖ составляет всего несколько дней.
Слышал, что между прививками против гепатита лучше не делать других прививок, правда ли это?
Информация о том, что между прививками против гепатита нежелательно делать другие прививки, является каким-то мифом, таких ограничений не существует. Например, в Национальном календаре профилактических прививок Российской Федерации между второй и третьей прививкой против гепатита В детям регламентировано введение вакцины против дифтерии-столбняка-коклюша-полиомиелита, пневмококковой и ХИБ-инфекции..
Одновременная вакцинация против гепатитов А и В
Какой интервал по времени должен быть между вакцинацией против гепатита А и гепатита B? Я слышала, что нельзя делать вакцинацию от гепатита A и B одновременно.
В соответствии с рекомендациями Национального календаря профилактических прививок Российской Федерации допускается введение вакцин (кроме вакцин для профилактики туберкулеза) в один день разными шприцами в разные участки тела. В России и в мире также зарегистрирована комбинированная вакцина против гепатитов А и В в одном шприце зарубежного производства.
В инструкции по применению вакцины против гепатита В написано, что прививка против гепатита B вводится детям и взрослым в дельтовидную мышцу плеча, а младенцам – в бедро. В нашей поликлинике всем детям делают эту вакцину в ягодицу, взрослым иногда под лопатку. Правильно ли это?
Неправильно. В соответствии с законодательством, медицинские препараты должны вводиться только тем способом, который указан в инструкции по их применению. В инструкциях к вакцинам против гепатита В указано внутримышечное введение детям старшего возраста и взрослым в дельтовидную мышцу (плечо), а маленьким детям – в бедро. В инструкциях по применению ряда вакцин против гепатита В написано, что их нельзя вводить в ягодицу.
По международным рекомендациям (Позиция ВОЗ относительно вакцин против гепатита В, 2009 год , вакцина против гепатита В должна вводиться внутримышечно в переднебоковую часть бедра (младенцам и детям до 2 лет) или в дельтовидную мышцу (детям старшего возраста и взрослым). Введение в ягодицу не рекомендуется, так как этот путь введения связывают с пониженным уровнем защитных антител (вакцина может не попасть в мышцу из-за толщины подкожной жировой клетчатки) и повреждением седалищного нерва.
Таким образом, для оптимального развития иммунной защиты вакцины против гепатита В должны быть введены внутримышечно, а не подкожно (на ягодице или под лопатку). По рекомендации развитых стран, вакцина против гепатита В, введенная в ягодицу, не должна засчитываться как правильная доза и должна быть введена правильно в ближайшее после ошибочного введения время («General Recommendations on Immunization - Recommendations of the Advisory Committee on Immunization Practices (ACIP) » ).
Вакцинация против гепатита В детей и взрослых при нарушении стандартной схемы введения
В каких официальных документах РФ (приказах, методических указаниях) определяется порядок проведения прививок против гепатита В при нарушении сроков начала введения или продолжения курса вакцинации?
Приказ Минздрава РФ от 21 марта 2014 г. N 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям» гласит
«Первая, вторая и третья вакцинации проводятся по схеме 0-1-6 (1 доза - в момент начала вакцинации, 2 доза - через месяц после 1 прививки, 3 доза - через 6 месяцев от начала вакцинации), за исключением детей, относящихся к группам риска, вакцинация против вирусного гепатита B которых проводится по схеме 0-1-2-12 (1 доза - в момент начала вакцинации, 2 доза - через месяц после 1 прививки, 2 доза - через 2 месяца от начала вакцинации, 3 доза - через 12 месяцев от начала вакцинации).… При изменении сроков вакцинации ее проводят по предусмотренным национальным календарем профилактических прививок схемам и в соответствии с инструкциями по применению иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней...»
Если ребенку вакцинация против гепатита В в роддоме не проведена, по какой схеме его прививать?
Если ребёнок не был привит против ВГВ в родильном доме, то вакцинацию следует начинать как можно раньше, при сохранении схемы 0-1-6 месяцев;
Если у ребенка с момента первой прививки против гепатита В в роддоме прошло более 3 месяцев, по какой схеме его прививать далее?
Международные рекомендации и рекомендации развитых стран говорят о том, что заново вакцинацию начинать не надо (Позиция ВОЗ относительно вакцин против гепатита В, 2009 год, www.who.int/immunization/Hepatitis_B_revised_Russian_Nov_09.pdf ) – «..Данные по иммуногенности вакцины дают основание полагать, что в любой возрастной группе перерыв в схеме вакцинации не требует возобновления всего курса прививок. Если первичный курс прерван после первой дозы, вторая доза должна быть введена как можно раньше..»
Прививали ребенка от гепатита В перед детским садом. Успели сделать 2 прививки, между 2 и 3 прививкой получается интервал 1,5 года. Медсестра в детском саду утверждает, что нам необходимо начинать прививаться снова.
По международным рекомендациям при таких увеличениях интервалов между прививками против гепатита В никаких дополнительных прививок не требуется, просто в любое ближайшее время проводится третья прививка против гепатита В, обеспечивающая длительный иммунитет на несколько десятков лет.
Я дважды пытался пройти цикл вакцинации против гепатита B, но точно не помню, доходил ли до его завершения (серия из трех прививок). Сейчас не знаю, как поступить. Безопасным ли будет начать весь цикл вакцинации сначала, несмотря, допустим, на 3 незавершившихся цикла ранее?
Каков максимальный интервал между первой и третьей прививкой от гепатита В? Можно ли делать последующие прививки вакцинами других производителей?
Теоретически, максимальный интервал между началом и окончание курса вакцинации против ГВ может быть любой. Но затягивание с проведением второй и третьей прививок затягивает формирование стойкого длительного иммунитета.
Нет разницы в иммуногенности, даже если последующие прививки проводятся вакцинами других производителей, рекомбинантные вакцины против гепатита В взаимозаменяемы.
Что будет, если вообще не вводить вторую и третью или третью дозу вакцины против гепатита В?
Какой интервал по времени допускается между второй и третьей прививкой против гепатита В. Достаточно ли двух прививок для получения стойкого иммунитета против гепатита В.
Минимальный интервал между второй и третьей прививкой должен быть не менее 4 недель. Максимальный интервал не регламентируется. Для формирования устойчивого длительного иммунитета необходим законченный курс вакцинации из трех прививок.
Две прививки у большинства привитых дают защитный уровень иммунитета, но как долго он будет продолжаться и насколько гарантированно - неизвестно.
Можно ли вводить прививки против гепатита В раньше стандартного возраста или срока?
Первую прививку против гепатита В сделали ребенку при рождении, через месяц сделали вторую. В возрасте 5 месяцев сделали третью прививку против гепатита В. Правильно ли это, ведь в календаре прививок указано, что третья вакцинация от гепатита В проводится в 6 месяцев?
Это неправильно. Более низкие уровни иммунного ответа отмечаются у младенцев, которым завершили стандартную серию прививок ранее, чем в возрасте 6 месяцев. В таком случае третья прививка не учитывается. Нужно повторить третью прививку, когда ребенку исполнится 6 месяцев (не ранее возраста 24 недель).
Ребенку 3 месяца. В поликлинике делают 3 прививки сразу одним днем (АКДС, против полиомиелита и гепатита В). Можно ли их делать сразу или лучше разбить через несколько дней? Стоит ли сделать все три прививки, или лучше отказаться временно от прививки против гепатита В, а остальные сделать?
Одновременное введение вакцин – международный стандарт, применяющийся для обеспечения безопасности ребенка. Одновременное введение снижает психологическую нагрузку на ребенка и родителей, снижает риск развития побочных реакций, снижает число посещений медицинского учреждения (соответственно и риска контактировать там с больными ОРЗ). Растягивание вакцинации путем введения прививок по одной ведет лишь к тому, что ребенка постоянно носят на уколы, на каждое введение есть вероятность развития побочных явлений, при каждом посещении поликлиники имеется риск заражения очередным ОРВИ. Никакой выгоды раздельная иммунизация не несет, это российское заблуждение и вред ребенку.
При введении младенцу трех вакцин одновременно можно сделать одну прививку в левое бедро, другую прививку в правое бедро, третью прививку в дельтовидную мышцу. Или, по возможности, использовать современные многокомпонентные вакцины, что сократит количество уколов.
Отказ от вакцинации оставит ребенка незащищенным от опасной инфекции. Исследования показывают, что если ребенку не сделали прививку против гепатита В в положенном возрасте со всеми остальными прививками, то потом родители вообще забывают ввести эту прививку и не приводят ребенка для этого в медицинское учреждение.
Ребенку 1 год и 2 месяца. От гепатита B начал прививаться в 3 месяца, на сегодняшний день с момента второй прививки прошло 4 месяца. Сейчас педиатр настаивает на третьей вакцинации от гепатита B и предлагает совместить ее с вакцинацией от кори, краснухи и паротита. Можно ли все это сделать в один день, или разбить по отдельности? Или вакцинацию от гепатита B нужно заново начинать?
Нужно сделать одновременно эти прививки, чтобы снизить психологическую и инъекционную нагрузку на ребенка и не водить его ежемесячно на укол. Одновременное введение вакцин - мировой стандарт и стандарт развитых стран. Начинать заново вакцинацию против гепатита В не нужно. Просто вводите третью прививку.
Из-за отсутствия вакцины в поликлинике до сегодняшнего момента третью прививку АКДС ребенку еще не сделали. Можно ли сейчас делать третью прививку гепатит В, не сделав третью прививку АКДС?
Прививки можно делать как в один день, так и раздельно. Отсутствие очередной АКДС никак не влечет за собой запрет на прививки против ГВ. Это какой-то миф.
Можно ли делать ребёнку в один день прививку БЦЖ и гепатит В?
В Приказе Минздрава РФ от 21 марта 2003 г. N 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" в Приложении N 5 указано - "Инструкция по вакцинации и ревакцинации против туберкулеза вакцинами БЦЖ и БЦЖ-М. – «...В день вакцинации во избежание контаминации никакие другие парентеральные манипуляции ребенку не проводят, в том числе обследование ребенка на фенилкетонурию и врожденный гипотиреоз».
Непосредственно на выработку иммунитета одновременное введение вакцин не влияет, такое разделение проводят из соображений безопасности в отношении вакцины БЦЖ.
Вакцинация детей и взрослых, близко контактирующих с носителями вируса гепатита В, проводится по схеме 0-1-2-12 мес.
При начале вакцинации в родильном доме, дети рожденные от матерей, являющихся носителями вируса гепатита В (схема 0-1-2-12).
Дети, родившиеся с весом ниже 1500 г у матерей-носителей HbsAg, прививаются вакциной против гепатита В в первые 12 часов жизни. Учитывая возможность их недостаточного иммунного ответа, таким детям рекомендуется одновременное введение иммуноглобулина человека против гепатита В в дозе 100 ME.
Я носитель HBsAg антигена. Дочке 17 мес. Вакцинация от гепатита В сделана по схеме 0-1-2. В 12 мес прививка не сделана. Необходимо сделать вакцину сейчас? Или сдать анализ на количество антител к вирусу и если оно нормальное, то можно не делать?
Первичный вакцинальный комплекс по экстренной схеме у Вашей дочери не закончен. Его надо завершить, обследование смысла не имеет, так как не может сказать, насколько стойким является иммунитет при незаконченном курсе вакцинации. Нужно просто сделать четвертую прививку. Иначе не сформируется длительный защитный иммунитет.
Ребенок ранее привит против гепатита В тремя прививками. Недавно у отца ребенка выявлен хронический гепатит В, мать здорова, привита 2 года назад. Нужны ли ребенку и матери дополнительные прививки?
Мой молодой человек является носителем вируса гепатита В. Узнали случайно. Анализы показали, что я не инфицирована. Каким образом вакцинироваться? Не повредит ли мне вакцина, если я вдруг уже тоже инфицирована?
Вакцинация против гепатита В в таком случае срочно показана. Для лиц, находящихся в близком контакте с носителями вируса ГВ, рекомендуется вакцинация по экстренной схеме 0-1-2-12 мес, где 0 – дата первой прививки. Пока не получите хотя бы три прививки, рекомендуется предохраняться с использованием презерватива.
Если Вы уже инфицированы - вакцина не принесет вреда, не будет только пользы.
У меня хронический гепатит С. Есть ли какая-то особенность вакцинации ребенка такой мамы?
Если у Вас нет вируса гепатита В, то вакцинация ребенка проводится как обычно, в соответствии с Национальным календарем, по схеме из трех прививок.
Привиться против гепатита В настоятельно рекомендуется и самому инфицированному вирусом гепатита С, так как присоединение к имеющейся инфекции еще и вируса гепатита В приводит к серьезной патологии печени.
Вакцинация детей и взрослых с различными нарушениями здоровья
Ребенок родился в 37 недель, маловесный, последствия гипоксии еще присутствуют, понижен мышечный тонус, снижен уровень гемоглобина. Можно ли на таком фоне прививать против гепатита В?
Иммунизация против гепатита В недоношенных детей проводится по всему миру и не противопоказана им ни при рождении, ни после.
Во время беременности ребенку поставили диагноз киста печени, в роддоме от прививок был медицинский отвод, билирубин был высокий, желтушка держалась до 4 мес. Не спровоцирует ли это какие-либо осложнения с печенью?
Вакцина против гепатита В не содержит цельного вируса ни в живом, ни в инактивированном виде, только фрагмент его оболочки, она не способна провоцировать заболевания печени, наоборот, защищает от развития заболевания печени – хронического гепатита В и его последствий (цирроз, рак).
Дети первых месяцев жизни, перенесшие тяжелые заболевания (сепсис, гемолитическую анемию, пневмонию, болезнь гиалиновых мембран и др.) и поправившиеся от них, вакцинируются в обычном порядке.
В три месяца ребенку прививку против гепатита В делать не стали, так как был низкий гемоглобин. Когда лучше сделать третью прививку? Врач сказала – только при наличии нормального анализа крови.
Анемия, выявленная при обследовании, никак не может являться медицинским отводом к вакцинации. Тем более не может повторный анализ крови быть фактором допуска к вакцинации - лечение и профилактика анемии у ребенка должна идти сама по себе, безо всякой привязки к проведению прививок.
Таким образом, вторую прививку против гепатита В нужно сделать в ближайшее время.
При хронических заболеваниях, которым не свойственны обострения (анемия, гипотрофия, рахит, астения и т.д.), следует привить ребенка и затем назначить или продолжить лечение. К сожалению, в российских условиях таких больных часто "готовят" к вакцинации, что лишь оттягивает ее проведение. Назначение общеукрепляющих, стимулирующих средств, витаминов, адаптогенов и т.д. не может являться поводом к отсрочке вакцинации. (Методические указания МУ 3.3.1.1095-02 "Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок".
Вакцинацию против гепатита В проводят сразу после рождения ребенка, так как он уязвим и не имеет защитного иммунитета, вирус легко передается при медицинских манипуляциях и в быту.
Инфицирование гепатитом В в младенческом возрасте у ряда детей приводит к раку печени и смерти до возраста 17 лет.
Россия является среднеэндемичной территорией по показателю пораженности HBsAg населения - от 2 до 7%. Поэтому всеобщая вакцинация новорожденных против гепатита В введена в календарь прививок РФ. Откладывание прививок приводит к откладыванию защиты против гепатита В. Как показывает практика, если прививка против гепатита В не сделана сразу, немалая часть родителей потом совсем не вакцинирует ребенка против гепатита В, так как для этого нужно планировать отдельное посещение врача, и родители говорят, что не имеют на это времени.
У нас в семье нет носителей вируса гепатита В, зачем прививать ребенка в роддоме?
Ребенок в первые же месяцы жизни подвергается множеству медицинских манипуляций при осмотрах и обследованиях. Медицинские манипуляции во всем мире представляют собой риск передачи вируса гепатита В. Чтобы заразиться вирусом гепатита В достаточно минимальных, невидимых глазом количеств инфицированного материала (крови и других биологических жидкостей). Вирус гепатита В в 100 раз более заразен, чем ВИЧ.
В родильных домах при первой вакцинации ребенка маме предлагают подписать расписку-согласие. Насколько мама может компетентно оценить готовность ребенка к прививке?
Противопоказаний для вакцинации младенца в роддоме очень мало, они связаны с очень тяжелым его состоянием (какая-то тяжелая всем видимая болезнь в момент новорожденности). Наличие или отсутствие тяжелой болезни может оценить любой человек, не только медицинский работник. Можете ознакомиться с методическими указаниями МУ 3.3.1.1095-02 "Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок".
Будет ли положительным тест на HBsAg при исследовании у привитого против гепатита В человека? Или прививка не должна давать положительный результат?
Вакцинация против гепатита В формирует защитные антитела к этому вирусу, которые в анализе крови называются как анти-HBsAg или а-HBsAg, но никак не может вызвать наличие HBsAg (HBs-антигена) в крови. Сам HBsAg (HBs-антиген, поверхностный антиген вируса гепатита В) у вакцинированного человека тоже может обнаружиться, если инфицирование им произошло до формирования защитного иммунитета или HBsAg был уже до вакцинации, но не выявлен.
Гепатит В - острое или хроническое заболевание печени, вызываемое ДНК-содержащим вирусом гепатита В (HBV). Передача инфекции происходит парентеральным путем. Гепатит В имеет различные клинико- морфологические варианты: от «здорового* носительства до злокачественных форм, хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы ЭПИДЕМИОЛОГИЯ
Гепатит В - антропонозная инфекция: единственный источник заражения - человек. Основным резервуаром служат «здоровые» вирусоносители; меньшее значение имеют больные с острыми и хроническими формами заболевания.
В настоящее время в мире, по неполным данным, насчитывается около 300 млн вирусоносителей, в том числе более 5 млн проживает на территории нашей страны.
HBV передаётся исключительно парентеральным путём: при переливании инфицированной крови или её препаратов (плазма, эритроцитарная масса, альбумин человека, протеин, криопреципитат*, антитромбин Ш и др.), использовании плохо простерилизованных шприцев, игл, режущих инструментов, а также при скарификациях, татуировках, оперативных вмешательствах, лечении зубов, эндоскопическом исследовании, дуоденальном зондировании и других манипуляциях, в ходе которых нарушается целостность кожных покровов и слизистых оболочек.
К естественным путям передачи HBV относят трансмиссию при половом контакте и вертикальную передачу от матери ребёнку. Половой путь передачи также следует рассматривать как парентеральный, поскольку заражение при этом происходит посредством инокуляции вируса через микротравмы слизистых оболочек половых органов.
Заражение детей от матерей - носительниц HBV происходит преимущественно в процессе родов в результате контаминации из содержащих кровь околоплодных вод через мацерированные кожные покровы и слизистые оболочки ребёнка. В редких случаях заражение ребёнка происходит сразу после рождения при теснт контакте с инфицированной матерью. Передача инфекции в этих случаях осу" ществляется через микротравмы, т.е. парентеральным путём, и, возможно, пр* кормлении грудью. Заражение ребёнка происходит, скорее всего, не через молоко а в результате попадания крови матери (из трещин сосков) на мацерированньк слизистые покровы полости рта ребёнка.
Восприимчивость населения к вирусу гепатита В, по-видимому, поголовная, ис исходом встречи человека с вирусом обычно становится бессимптомная инфекция. Частота атипичных форм не поддаётся точному учёту, но если судить по выявлению серопозитивных лиц, то на каждый случай манифестного гепатита В приходятся десятки и даже сотни субклинических форм.
В результате перенесённого гепатита В формируется стойкий пожизненный иммунитет. Повторное заболевание маловероятно.
ПРОФИЛАКТИКА
Заключается в первую очередь в тщательном обследовании всех категорий доноров с обязательным исследованием крови на HBsAg при каждой сдаче с использованием высокочувствительных методов его идентификации (ИФА, РИА), а также определение активности АЛТ.
Не допускают к донорству лиц, перенёсших в прошлом вирусный гепатит, больных хроническими заболеваниями печени, а также лиц, получавших переливания крови и её компонентов в течение последних 6 мес. Запрещено использовать для трансфузии кровь и ее компоненты от доноров, не обследованных на HB^Ag.
Для повышения безопасности препаратов крови рекомендуется обследовать доноров не только на HBsAg, но и на анти-НВс. Отстранение от донорства лиц, имеющих анти-НВс, рассматриваемых как скрытые носители HBsAg, практически исключает возможность постгрансфузионного гепатита В.
Для предупреждения заражения новорождённых всех беременных дважды обследуют на HBjAg высокочувствительными методами: при взятии беременной на учёт (8 нед беременности) и при оформлении декретного отпуска (32 нед). В случае выявления HBsAg вопрос о вынашивании беременности следует решать строго индивидуально. Важно учитывать, что риск внутриутробного инфицирования плода особенно велик при наличии у женщины HB^Ag и ничтожно мал при его отсутствии, даже если HBjAg обнаруживается в высокой концентрации. Существенно уменьшается риск инфицирования ребёнка и при родоразрешении путём кесарева сечения.
Прерывание путей передачи инфекции достигают применением одноразовых шприцев, игл, скарификаторов, зондов, катетеров, систем для переливания крови, другого медицинского инструментария и оборудования, используемого при проведении манипуляций, связанных с нарушением целостности кожных покровов и слизистых оболочек.
Все медицинские инструменты и оборудование повторного применения должны подвергаться тщательной предстерилизационной очистке и стерилизации после каждого использования.
Для профилактики посттрансфузионного гепатита большое значение имеет строгое соблюдение показаний к гемотерапии. Переливание консервированной крови и ее компонентов (эритроцитарная масса, плазма, антитромбин III. концентраты VII фактора) делают только по жизненным показаниям и отмечают в истории болезни. Необходимо переходить по возможности на переливание заменителей крови или, в крайнем случае, переливать её компоненты (альбумин*, специально отмытые эритроциты, протеин, плазма). Это связано с тем, что пастеризация плазмы (60 °С, 10 ч), хотя и не гарантирует полной инактивации HBV, всё же снижает опасность заражения; ещё меньше риск инфицирования при переливании альбумина*, протеина и ничтожна мала опасность инфицирования при переливании иммуноглобулинов.
В отделениях высокого риска заражения гепатитом В (центры гемодиализа, реанимационные блоки, палаты интенсивной терапии, ожоговые центры, онкологические стационары, гематологические отделения и др.) обеспечение профилактики гепатита В достигают путём строжайшего соблюдения противоэпидемических мероприятий: использование одноразового инструментария, закрепление каждого аппарата за фиксированной группой больных, тщательная очистка от крови сложных медицинских аппаратов, максимальное разобщение больных, ограничение парентеральных вмешательств и др. Во всех этих случаях идентификацию HBsAg проводят высокочувствительными методами и не реже 1 раза в месяц.
Для предупреждения профессиональных заражений все сотрудники должны работать с кровью в резиновых перчатках и строго соблюдать правила личной гигиены.
Для предотвращения распространения инфекции в семьях больных гепатитом и носителей HBV проводят текущую дезинфекцию, строго индивидуализируют предметы личной гигиены (зубные щётки, полотенца, постельное бельё, мочалки, расчёски, бритвенные принадлежности и др.). Всем членам семьи разъясняют, при каких условиях может произойти заражение. За членами семей больных хроническим гепатитом В и носителей HBgAg устанавливают медицинское наблюдение.
Специфическую профилактику гепатита В достигают путём пассивной и активной иммунизации детей с высоким риском инфицирования.
Для пассивной иммунизации используют иммуноглобулин с высоким содержанием антител к HBsAg (титр в реакции пассивной гемагглютинации 1:100 000-1:200 000). Такой иммуноглобулин получают из плазмы доноров, в крови которых выявляют анти-НВ,. в высоком титре.
Показания к иммуноглобулинопрофилактике у детей.
Детям, рождённым от матерей - носительниц HBaAg или заболевших острым гепатитом В в последние месяцы беременности (иммуноглобулин вводят сразу после рождения, а затем повторно через 1, 3 и 6 мес).
После попадания в организм вируссодержащего материала (перелита кровь или её компоненты от больного или носителя HBV, случайные порезы, уколы с предполагаемой контаминацией вирусе оде ржащим материалом). В этих случаях иммуноглобулин вводят в первые часы после предполагаемого инфицирования и через 1 мес.
При длительно сохраняющейся угрозе инфицирования (дети, поступающие в центры гемодиализа, больные гемобластозами и др.) - вводят повторно с различными интервалами (через 1-3 мес или каждые 4-6 мес). Эффективность пассивной иммунизации зависит в первую очередь от сроков введения иммуноглобулина. При введении сразу после инфицирования профилактический эффект достигает 90%, в сроки до 2 сут - 50-70%. а при введении после 5 сут иммуноглобулинопрофилактика практически неэффективна.
При внутримышечном введении иммуноглобулина пик концентрации анти-НВй в крови наступает через 2-5 сут. Для получения более быстрого защитного эффекта можно ввести иммуноглобулин внутривенно.
Период выведения иммуноглобулина колеблется в пределах от 2 до 6 мес. Надежный защитный эффект отмечают лишь в первый месяц после введения, поэтому для получения пролонгированного эффекта необходимо повторное введение иммуноглобулина. Кроме того, применение иммуноглобулина эффективно только при низкой инфицирующей дозе HBV. В случае массивного заражения (переливания крови, плазмы и др.) иммуноглобулинопрофилактика малоэффективна.
Несмотря на недостатки, введение специфического иммуноглобулина может занять достойное место в профилактике гепатита В. По данным литературы, свое-
временное введение специфического иммуноглобулина позволяет предупредить заражение гепатитом В у 70-90% привитых.
Для активной профилактики гепатита В используют генно-инженерные вакцины.
В нашей стране создано несколько рекомбинантных вакцин против гепатита В (производства ЗАО «Комбиотех» и др.). Кроме того, зарегистрированы и разрешены к применению несколько зарубежных препаратов (энджерикс В*; HB-VAX II*, эувакс В*; шенвак-В*; эбербиовак АВ*, регевак В* др.).
Активной иммунизации против гепатита В подлежат:
♦ все новорождённые в первые 24 часа жизни, включая детей, рожденных здоровыми матерями, и детей из групп риска, которые включают новорожденных, родившихся от матерей, носительниц HBsAg, больных вирусным гепатитом В или перенесших вирусный гепатит В в третьем триместере беременности, не имеющих результатов обследования на маркёры гепатита В, а также отненесенных к группам риска: наркозависимых, в семьях, в которых есть носительтво HBsAg или больной острым вирусным гепатитом В и хроническими вирусными гепатитами;
♦ новорождённые в районах, эндемичных по гепатиту В, с уровнем носитель-ства HBsAg более 5%;
♦ больные, которым часто проводят различные парентеральные манипуляции (хроническая почечная недостаточность, СД, болезни крови, предполагаемая операция с использованием аппарата искусственного кровообращения и др.);
> лица, тесно контактирующие с HBgAg-носителями (в семьях, закрытых детских коллективах);
♦ медицинский персонал гепатитных отделений, центров гемодиализа, отделений службы крови, хирурги, стоматологи, патологоанатомы;
♦ лица, получившие случайную травму инструментами, загрязненными кровью больных гепатитом В или носителями HB£Ag.
Вакцинацию проводят троекратно по схеме 0, 1, 6 мес, здоровым детям - 0, 3, 6 мес. Допустимы и другие схемы: 0,1, 3 мес или 0,1,12 мес. Ревакцинацию проводят через каждые 5 лет.
Активной иммунизации подлежат только лица, в крови у которых не выявляют маркёров HBV (HB^g, анти-НВс, анти-НВ5). При наличии одного из маркёров гепатита В вакцинацию не проводят.
Эффективность вакцинации очень высокая. Многочисленные исследования показывают, что при введении вакцины по схеме 0,1,6 мес у 95% лиц формируется протективный иммунитет, обеспечивающий надёжную защиту от инфекции HBV в течение 5 и более лет.
Противопоказаний к вакцинации против гепатита В нет. Вакцина безопасна, ареактогенна. С помощью вакцинации удается снизить заболеваемость гепатитом В в 10-30 раз.
Для предотвращения вертикальной передачи HBV первую фазу вакцинации проводят сразу, после рождения (не позднее 24 ч), затем вакцинируют через 1, 2 и 12 мес. С этой целью можно применять комбинированную пассивно-активную иммунизацию новорождённых от матерей, больных гепатитом В, или вирусо-носительниц. Специфический иммуноглобулин вводят сразу после рождения, а вакцинацию проводят в первые 2 сут. Вакцинацию проводят в режиме 0,1, 2 мес с ревакцинацией в 12 мес. Такая пассивно-активная иммунизация снижает риск инфицирования ребёнка у матерей с HBEAg с 90 до 5%.
Широкое внедрение вакцинации против гепатита В позволит снизить заболеваемость не только острым, но и хроническим гепатитом В, а также циррозом и первичным раком печени.
КЛАССИФИКАЦИЯ
Клинически гепатит В так же, как и гепатит А, классифицируют по типу, тяжести и течению. Критерии для определения типа и выделения клинических форм такие же, как при гепатите А. Однако наряду с лёгкими, среднетяжёлыми и тяжёлыми формами выделяют ещё злокачественную форму, которую наблюдают почти исключительно при гепатите В и гепатите дельта, а течение, кроме острого и затяжного, бывает хроническим.
Клинические и лабораторные критерии безжелтушных, стёртых, субклинических, а также лёгких, среднетяжёлых и тяжёлых форм при гепатите В принципиально не отличаются от таковых при гепатите А.
ЭТИОЛОГИЯ
Возбудитель - ДНК-содержащий вирус из семейства гепаднавирусов (от греч. hepar - печень и англ. DNA - ДНК).
Вирус гепатита В (частицы Дейна) - сферическое образование диаметром 42 нм, состоящее из злектронноплотной сердцевины (нуклеокапсид) диаметром 27 нм и внешней оболочки толщиной 7-8 нм. В центре нуклеокапсида находится генам виругя, представленный двунитчатой ДНК.
В составе вируса содержатся 3 антигена, имеющие важнейшее значение для лабораторной диагностики заболевания:
♦ HB^g - ядерный, сердцевинный антиген, имеющий белковую природу;
♦ HB^Ag - трансформированный HB^g (антиген инфекциозности);
♦ HBsAg - поверхностный (австралийский антиген), образующий наружную оболочку частицы Дейна.
HBV весьма устойчив к высоким и низким температурам. При температуре 100 "С вирус погибает через 2-10 мин; при комнатной температуре сохраняется 3-6 мес, в холодильнике - 6-12 мес, в замороженном виде - до 20 лет; в высушенной плазме - 25 лет. Вирус чрезвычайно устойчив к воздействию химических факторов: 1-2% раствор хлорамина убивает вирус через 2 ч, 1,5% раствор формалина - через 7 сут. Вирус устойчив к лиофилизации, воздействию эфира. ультрафиолетовым лучам, действию кислот и др. При автоклавировании (120 °С) активность вируса полностью подавляется только через 5 мин, а при воздействии сухого жара (160 °С) - через 2 ч.
ПАТОГЕНЕЗ
В механизме развития патологического процесса при гепатите В можно выделить несколько ведущих звеньев:
♦ внедрение возбудителя - заражение;
♦ фиксация на гепатоците и проникновение внутрь клетки;
<> размножение и выделение вируса на поверхность гепатоцита. а также в
кровь; о- включение иммунных реакций, направленных на элиминацию возбудителя;
♦ поражение внепечёночных органов и систем;
■«■ формирование иммунитета, освобождение от возбудителя, выздоровление.
КЛИНИЧЕСКАЯ КАРТИНА
В типичных случаях болезни выделяют четыре периода: инкубационный, начальный (преджелтушный), период разгара (желтушный) и реконвалесценции.
Инкубационный период продолжается 60-180 дней, чаще 2-4 мес, в редких случаях он укорачивается до 30-45 дней или удлиняется до 225 дней. Длительность инкубационного периода зависит от инфицирующей дозы и возраста детей. При массивном инфицировании (переливаниях крови или плазмы) инкубационный период короткий - 1,5-2 мес, а при парентеральных манипуляциях (подкожные и внутримышечные инъекции) и особенно при бытовом инфицировании продолжительность инкубационного периода 4-6 мес. У детей первых месяцев жизни инкубационный период обычно короче (92,8±1,6 дня), чем у детей старших возрастных групп (117,8±2,6дня).
Клинические проявления заболевания в этом периоде полностью отсутствуют, но, как и при гепатите А, в конце инкубации в крови характерна постоянно высокая активность печёночно-клеточных ферментов и выявление маркёров активно текущей инфекции: HBjAg, HBjAg, анти-НВс IgM.
Начальный (ореджелтушный) период. Заболевание чаще (65%) начинается постепенно. Повышение температуры тела отмечают не всегда (40%) и обычно не в первые сутки болезни. У больного можно отметить вялость, слабость, повышенную утомляемость, снижение аппетита. Нередко эти симптомы настолько слабо выражены, что их просматривают, и болезнь как бы начинается с потемнения мочи и появления обесцвеченного кала. В редких случаях начальные симптомы бывают резко выраженными: тошнота, повторная рвота, головокружение, сонливость. Часто возникают диспепсические расстройства: снижение аппетита вплоть до анорексии, отвращение к пище, тошнота, рвота, метеоризм, запор, реже понос. Дети старшего возраста жалуются на тупые боли в животе. При осмотре в этом периоде можно выявить общую астению, анорексию, увеличение, уплотнение и болезненность печени, а также потемнение мочи и нередко обесцвечивание кала.
Мышечно-суставные боли, часто встречающиеся у взрослых больных, у детей в преджелтушном периоде бывают очень редко.
Редко в преджелтушном периоде наблюдают кожные высыпания, метеоризм, расстройство стула.
Катаральные явления вообще не характерны для гепатита В.
Наиболее объективными симптомами в начальном периоде становятся увеличение, уплотнение и болезненность печени.
Изменения в периферической крови в начальном периоде гепатита В не характерны. Можно отметить лишь небольшой лейкоцитоз, тенденцию к лимфоцитозу; СОЭ всегда в пределах нормы.
У всех больных уже в преджелтушном периоде в сыворотке крови выявляют высокую активность АЛТ, ACT и других гепатоцеллюлярных ферментов; в конце этого периода в крови повышается содержание конъюгированного билирубина, но показатели осадочных проб, как правило, не изменяются, диспротеинемии нет. В крови циркулируют в высокой концентрации HB5Ag, HBpAg, анти-НВс IgM, часто выявляется ДНК вируса.
Продолжительность начального (преджелтушного) периода может составлять от нескольких часов до 2-3 нед; в среднем 5 сут.
Желтушный период (разгар заболевания). За 1-2 дня до появления желтухи у больных отмечают потемнение мочи и у большинства - обесцвечивание кала. В отличие от гепатита А при гепатите В переход заболевания в третий, желтушный период в большинстве случаев не сопровождается улучшением общего состояния. Наоборот, у многих детей симптомы интоксикации усиливаются.
Желтуха нарастает постепенно, обычно в течение 5-7 сут, иногда 2 нед и дольше. Желтушность может варьировать от слабо-жёлтого, канареечного или лимонного до зелёновато-жёлтого или охряно-жёлтого, шафранного цвета. Выраженность и оттенок желтушности связаны с тяжестью заболевания и развитием синдрома холестаза.
Достигнув пика выраженности, желтушность при гепатите В обычно стабилизируется в течение 5-10 дней, и только после этого начинается её уменьшение.
Редким симптомом гепатита В у детей можно считать высыпания на коже. Сыпь располагается симметрично на конечностях, ягодицах и туловище, бывает пятнисто-папулёзной, красного цвета, диаметром до 2 мм. При сдавливании сыпь принимает охряную окраску, через несколько дней в центре папул появляется слабое шелушение. Эти высыпания следует трактовать как синдром Джанотти-Крости, описанный итальянскими авторами при гепатите В.
При тяжёлых формах в разгаре заболевания возможны проявления геморрагического синдрома: точечные или более значительные кровоизлияния в кожу.
Параллельно нарастанию желтухи при гепатите В увеличивается печень, её край уплотняется, возникает болезненность при пальпации.
Увеличение селезёнки наблюдают реже, чем увеличение печени. Селезёнка чаще бывает увеличенной в более тяжёлых случаях и при длительном течении болезни. Увеличение селезёнки отмечают в течение всего острого периода с медленной обратной динамикой. Нередко селезёнка пальпируется и после исчезновения прочих (за исключением увеличения печени) симптомов, что, как правило, указывает на затяжное или хроническое течение болезни.
В периферической крови на высоте желтухи число эритроцитов имеет тенденцию к понижению. При тяжёлых формах развивается анемия. В редких случаях возможны более тяжёлые изменения в костном мозге вплоть до развития панмиелофтиза.
В желтушном периоде количество лейкоцитов нормальное или понижено. В лейкоцитарной формуле на высоте токсикоза выявляют наклонность к нейтрофи-лёзу, а в периоде выздоровления - климфоцитозу. СОЭ обычно в пределах нормы. Низкая СОЭ (1-2 мм/ч) при выраженной интоксикации у больного с тяжёлой формой гепатита В служит неблагоприятным признаком.
Реконвалесцентный, восстановительный период. Общая продолжительность желтушного периода при гепатите В колеблется от 7-10 сут до 1,5-2 мес. С исчезновением желтухи дети уже не предъявляют жалоб, они активны, у них восстанавливается аппетит, но у половины больных сохраняется гепатомегалия, а у 2Д - незначительная гиперферментемия. Может быть повышена тимоловая проба, возможны явления диспротеинемии и др.
В реконвалесцентном периоде в сыворотке крови обычно уже не выявляют HBsAg и тем более HBeAg. но зато всегда обнаруживают анти-НВЕ, анти-HBj. IgG и нередко анти-НВ3.
Злокачественная форма бывает почти исключительно у детей 1-го года жизни. Клинические проявления злокачественных форм зависят от распространённости некрозов печени, темпа их развития, стадии патологического процесса. Различают начальный период болезни, или период предвестников, период развития массивных некрозов печени, что обычно соответствует состоянию прекомы и быстро прогрессирующей декомпенсации печёночных функций, клинически проявляющихся комой I и комой П.
Заболевание чаще начинается остро: температура тела повышается до 38-39 °С, появляются вялость, адинамия, иногда сонливость, сменяющаяся приступами беспокойства или двигательным возбуждением. Выражены диспепсические расстройства: тошнота, срыгивание, рвота (часто повторная), иногда понос.
С появлением желтухи наиболее постоянными симптомами становятся: психомоторное возбуждение, повторная рвота с примесью крови, тахикардия, учащённое токсическое дыхание, вздутие живота, выраженный геморрагический синдром, повышение температуры тела и снижение диуреза. Рвота «кофейной гущей», инверсия сна, судорожный синдром, гипертермия, тахикардия, учащённое токсическое дыхание, печёночный запах изо рта, уменьшение печени наблюдают только при злокачественных формах болезни. Вслед за этими симптомами или одновременно с ними наступает затемнение сознания с клинической симптоматикой печёночной комы.
Среди биохимических показателей наиболее информативны;
о билирубинпротеидная диссоциация - при высоком содержании билирубина в сыворотке крови уровень белковых комплексов резко снижается;
♦ билирубинферментная диссоциация - при высоком содержании билирубина наблюдают падение активности печёночно-клеточных ферментов, а также падение уровня факторов свёртывания крови.
Общие принципы лечения больных острым гепатитом В такие же, как и при гепатите А. Тем не менее, необходимо учитывать, что гепатит В в отличие от гепатита А, нередко протекает в тяжёлой и злокачественной форме. Кроме того, заболевание может заканчиваться формированием хронического гепатита и даже цирроза.
В настоящее время нет принципиальных возражений против того, чтобы дети с лёгкими и среднетяжёлыми формами гепатита В лечились в домашних условиях. Результаты лечения таких больных в домашних условиях не хуже, а по некоторым показателям даже лучше, чем в стационаре.
Конкретные рекомендации в отношении двигательного режима, лечебного питания и критериев их расширения в принципе такие же. как и при гепатите А; следует лишь учитывать, что сроки всех ограничений при гепатите В обычно несколько длиннее в полном соответствии с течением болезни.
Обобщённо можно сказать, что при гладком течении болезни все ограничения в двигательном режиме и питании должны быть сняты через 6 мес от начала заболевания, а занятия спортом можно разрешить через 12 мес.
Медикаментозную терапию проводят по тем же принципам, как и при гепатите А. В дополнение к этой базисной терапии при среднетяжёлых и тяжёлых формах гепатита В можно применять интерферон внутримышечно по 1 млн ЕД 1-2 раза в сутки в течение 15 дней.
С целью профилактики перехода острого процесса в хронический целесообразно назначать индуктор интерферона - циклоферон* (из расчёта 10-15 мг/кг), длительность курса - 15 приёмов.
При тяжёлых формах болезни с целью детоксикации показано внутривенное введение 1,5% раствора реамберина*, реополиглюкин\ 10% раствор глюкозы* до 500-800 мл/сут, а также назначают глюкокортикоиды из расчёта 2-3 мг/кг в сутки по преднизолону в течение первых 3-4 сут (до клинического улучшения) с последующим быстрым уменьшением дозы (курс не более 7-10 дней). У детей 1-го года жизни показанием к назначению глюкокортикоидов служат и среднетя-жёлые формы болезни.
При подозрении на злокачественную форму или при угрозе её развития назначают:
* глюкокортикоиды до 10-15 мг/кг в сутки по преднизолону внутривенно равными дозами через 3-4 ч без ночного перерыва;
* альбумин*, реополиглюкин*, 1,5% раствор реамберина*, 10% раствор глюкозы* из расчёта 100-200 мл/кг в сутки в зависимости от возраста и диуреза;
* ингибитор протеолиза апротинин (например: трасилол 500 000*, гордокс*. контрикал*) в возрастной дозе;
«■ лазикс* по 2-3 мг/кг и маннитол по 0,5-1 г/кг внутривенно струйно медленно для усиления диуреза;
■о- по показаниям (синдром диссеминированного внутрисосудистого свёртывания) гепарин натрия по 100-300 ЕД/кг внутривенно.
Для предупреждения всасывания из кишечника токсичных метаболитов, образующихся в результате жизнедеятельности микробной флоры, назначают высокие очистительные клизмы, промывание желудка, вводят антибиотики широкого спектра действия (гентамицин, полимиксин).
Сообщают о положительном влиянии полиферментного препарата вобэнзим*, который оказывает противовоспалительное иммуномодулирующее действие, улучшает микроциркуляцию.
Тактивин* назначают по 2-3 мл ежедневно в течение 10-12 дней с целью нормализации количественных и функциональных показателей иммунитета и предотвращению осложнений, связанных с сопутствующими инфекционными заболеваниями.
В случае неэффективности комплекса терапевтических мероприятий следует провести повторные сеансы плазмафереза. Менее эффективны повторные сеансы гемосорбции и заменные переливания крови.
В комплекс патогенетических средств целесообразно включать и гипербарическую оксигенацию (1-2 сеанса в сутки: компрессия 1,6-1,8 атм, экспозиция 30-45 мин).
Успех лечения злокачественных форм в основном зависит от своевременности проведения изложенной выше терапии. В случае развития глубокой печёночной комы терапия малоэффективна.
Введение…………………………………………………………………………3
1. Пассивная иммунизация …………………………………………………....4
2. Иммуноглобулины ………………………………………………………….5
3. Гаммаглобулины…………………………………………………………….7
4. Препараты, предназначенные для пассивной иммунизации …………….9
Заключение ……………………………………………………………………14
Литература……………………………………………………………………..15
Введение
Активная иммунизация, или вакцинация, представляет собой введение вакцины или анатоксина для формирования длительной защиты организма. Живые вакцины обычно противопоказаны больным, получающим иммуносупрессоры, на фоне лихорадки или в период беременности
Пассивная иммунизация обеспечивает создание временного иммунитета в организме путем введения чужеродных иммунных субстанций, таких как антитела.
Активная иммунизация действует профилактически - через определенное время и на длительный срок (после вакцинации Столбнячным Анатоксином (АС) - 2 года, после 1-й ревакцинации АС - до 5 лет, после нескольких ревакцинаций АС - до 10 лет).
Пассивные иммунные препараты (иммуноглобулин, сыворотки) действуют немедленно, но быстро разрушаются, что не позволяет их использовать для длительной защиты от инфекций. Зато это великолепное средство для экстренной профилактики бешенства (при укусах), столбняка (при травмах), гриппа, кори, паротита, клещевого энцефалита и ряда других инфекций, а также лечения стафилококковой инфекции и лихорадки Эбола.
Вакцинация против инфекционных заболеваний является одним из наиболее мощных и эффективных методов клинической медицины. Благодаря иммунизации многие ранее широко распространенные инфекции, например, оспа, полиомиелит, корь. Были устранены или существенно ограничены. Тем не менее, благодушие и социально-экономические границы мешают проведению иммунизации, соответствующей потребностям человечества. Взрослые, в частности, обычно не получают иммунизации против пневмококковой, и столбнячно-дифтерийной инфекции.
1. Пассивная иммунизация
Пассивная иммунизация - введение антител к каким-либо антигенам. С помощью пассивной иммунизации можно создать только временный иммунитет продолжительностью 1-6 нед. Хотя пассивная иммунизация вызывает кратковременное повышение устойчивости к возбудителю, ее действие проявляется немедленно. Повторная пассивная иммунизация не усиливает иммунитет и часто сопровождается осложнениями. Ее обычно проводят после контакта с возбудителем и при невозможности активной иммунизации.
К пассивной иммунизации прибегают для создания временного иммунитета после контакта с возбудителем инфекции в тех случаях, когда активная иммунизация по тем или иным причинам не проводится заранее (например, против цитомегаловируса, против бешенства).
Пассивную иммунизацию применяют также для лечения заболеваний, вызванных бактериальными токсинами (в частности, дифтерии), укусов ядовитых змей, укусов пауков и для специфической (анти-Rh0(D)-иммуноглобулин) и неспецифической (антилимфоцитарный иммуноглобулин) иммуносупрессии.
Для пассивной иммунизации пользуются тремя видами препаратов:
- нормальными человеческими иммуноглобулинами (устаревшее название - гаммаглобулин) для в/м или в/в введения;
- специфическими человеческими иммуноглобулинами с высоким содержанием антител против определенных возбудителей (например, против вируса гепатита В);
- специфическими сыворотками, в том числе антитоксическими, полученными от иммунизированных животных.
2. Иммуноглобулины
Данный тип иммунных препаратов содержат антитела в готовом виде. Их применяют с лечебной, профилактической целями, а также для проведения экстренной профилактики инфекционных заболеваний.
Иммуноглобулины могут иметь противомикробное, противовирусное или антитоксическое действие.
Иммуноглобулин получают из плацент или донорской крови. Последний более очищенный и не содержит гормональных веществ. Наконец, возможно получение одногрупного венозного иммуноглобулина.
Положительные стороны применения иммуноглобулинов - в организм вводится готовый набор антител в достаточной дозе в течение короткого промежутка времени. В то же время, препарат сравнительно быстро разрушается, подавляет синтез собственного иммуноглобулина, аллергизирует организм. Кроме аллергизирующего действия самого иммуноглобулина, небезразличны для организма неспецифические иммуноглобулины с гетерогенными аллотипами, изотипами и антителами к ним, аллергические субстанции и примеси - групповые факторы крови, изоантитела, гормоны, ферменты, аминокислоты и др. Последние при длительном хранении оголяют активный центр иммуноглобулина и образует фрагменты, которые дополнительно сенсибилизируют организм.
Лечебные сыворотки, явились прообразом современных иммуноглобулиновых препаратов, а некоторые из них (противодифтерийная и противостолбнячная) и по сей день не утратили своего клинического значения. Однако развитие технологии переработки препаратов крови позволило воплотить идеи пассивной иммунизации сначала в виде концентрированных иммуноглобулиновых препаратов для внутримышечного введения, а затем и иммуноглобулинов для внутривенного введения.
Долгое время эффективность иммуноглобулиновых препаратов объяснялась исключительно за счет пассивного переноса антител. Связываясь а соответствующими антигенами, антитела нейтрализуют их, переводят в нерастворимую форму, в результате чего запускаются механизмы фагоцитоза, комплемент-зависимого лизиса и последующей элиминации антигенов из организма.
Однако, в последние годы в связи с доказанной эффективностью внутривенных иммуноглобулинов при некоторых аутоиммунных заболеваниях активно изучается собственно иммуномодулирующая роль иммуноглобулинов. Так у внутривенных иммуноглобулинов обнаружена способность изменять продукцию интерлейкинов и уровень экспрессии рецепторов к ИЛ-2. Также продемонстрировано воздействие препаратов иммуноглобулинов на активность различных субпопуляций Т-лимфоцитов и стимулирующее действие на процессы фагоцитоза.
Внутримышечные иммуноглобулины, используемые с 50-х годов, имеют относительно низкую биодоступность. Резорбция препарата осуществляется из места введение в течение 2-3- суток и больше половины препарата повергается разрушению протеолитическими ферментами.
Длительность создаваемого иммунитета зависит от концентрации антител в препарате и их стабильности; в среднем период полураспада пассивно введенных гомологичных антител составляет 35-40 дней. Повторные введения иммуноглобулина допускаются лишь в исключительно неблагополучных ситуациях: из-за выработки антииммуноглобулиновых антител эффективность дробной пассивной иммунизации значительно ниже, чем одномоментной.
В тактике иммуноглобулино-профилактики различают два вида действий:
1) введение иммуноглобулина до вероятного контакта с возбудителем, например, при выезде иммунизированного лица в эндемичный по данной инфекции район;
2) введение иммуноглобулина после вероятного контакта с возбудителем, возможно даже в стадии инкубации, например, в детском учреждении после выявления случая(ев) инфекционного заболевания и изоляции его источника.
По понятным причинам эффективность профилактики в первой ситуации будет выше, чем во второй при прочих равных условиях. При гепатите В профилактические введения специфического иммуноглобулина с высоким содержанием антител к поверхностному антигену вируса, анти-HBs рекомендуется делать новорожденным, матери которых перенесли это заболевание в течение беременности или являются хроническими носителями HBs - антигена, поскольку в данных случаях вероятность инфицирования ребенка очень высока. Специфический анти-HBs иммуноглобулин применяется также для предотвращения заболевания у персонала больниц, станций переливания крови и научных лабораторий после травматического повреждения кожи или слизистых, имевших место при работе с кровью человека.
3. Гаммаглобулины
Глобулин - представитель группы простых белков, который хорошо растворяется в разбавленных солевых растворах и свертывается под действием тепла. В крови присутствуют различные глобулины (сывороточные глобулины (serum globulins)), в том числе альфа, бета и гаммаглобулины. Некоторые глобулины выполняют важные функции в качестве антител; другие отвечают за перенос липидов, железа и меди в кровеносном русле. Почти все гаммаглобулины являются иммуноглобулинами.
Иммуно-(гамма-) глобулинопрофилактика достаточно широко применялась как средство борьбы с гепатитом А. Инъекция гаммаглобулина обеспечивает человеку временную защиту от гепатита А; кроме того, недавно было установлено, что в результате этих инъекций уменьшается вероятность поражения венечных артерий болезнью Кавасаки.
Сведения о ее эффективности противоречивы, что объясняется, очевидно, разнообразием эпидемических ситуаций и нестандартностью используемых препаратов в отношении содержания антител. Были рекомендованы массовые введения иммуноглобулина в период, предшествующий ожидаемому подъему заболеваемости (т.н. предсезонная профилактика) и небольшие по масштабам прививки в детских коллективах, в которых регистрировались случаи желтухи (т.н. профилактика по показаниям). В настоящее время показания к применению иммуноглобулина для профилактики гепатита А резко ограничены. При всех обстоятельствах профилактика гепатита А с помощью иммуноглобулина не оказывала влияния на эпидемический процесс, т.е. распространение инфекции на данной территории, хотя и предотвращала развитие желтушных форм у своевременно привитых лиц.
В начале использовались гетерогенные препараты сыворотки и иммуноглобулины, полученные от иммунизированных животных. На втором этапе получили гомогенные сыворотки - т.е. сыворотки от иммунизированного человека. При использовании сыворотки в организм реципиента вводится много балластных веществ, поэтому более рационально использование иммуноглобулина (гаммаглобулина), являющегося одной из фракций общего белка крови.
Применяемые с лечебной целью специфические антитела выпускаются промышленностью в виде иммунных сывороток или активных в иммунном отношении фракций - иммуноглобулинов.
Их готовят из крови людей (гомологичные) или животных (гетерологичные). Гомологичные иммунные препараты обладают определенным преимуществом перед гетерологичными в связи со сравнительно большой продолжительностью (до 1-2 мес) их циркуляции в организме и отсутствием у них побочных эффектов.
Сыворотки и иммуноглобулины, изготовленные из крови животных, действуют сравнительно недолго (1-2 нед) и способны вызывать побочные реакции. Их можно применять только после проверки чувствительности организма больного с помощью внутрикожной пробы с разведенными препаратами.
Сыворотку назначают при отрицательной пробе, для предотвращения осложнений вводят по Безредко, после предварительной десенсибилизации организма, осуществляемой путем последовательного подкожного (с интервалом в 30-60 мин) введения небольших порций этого вещества. Затем внутримышечно применяется вся доза лечебной сыворотки. При отдельных формах экзотоксических инфекций (токсическая дифтерия зева) 1/2-1/3 часть препарата при первом его введении может применяться внутривенно.
4. Препараты, предназначенные для пассивной иммунизации
В России выпускаются внутримышечные иммуноглобулины, содержащие повышенные титры антител к антигенам определенных возбудителей: вирусу клещевого энцефалита, гриппу, герпесу и цитомегаловирусу, НВS - антигену (Антигеп).
Внутривенные иммуноглобулины имеют существенные преимущества, т.к. их применение позволяет в кратчайшие сроки создавать в крови эффективные концентрации антител.
Внутривенные иммуноглобулины применяются при первичных иммунодефицитах (агаммаглобулинемия, селективный дефицит IgG, и др.), гипогаммаглобулинемии при хроническом лимфолейкозе, тромбоцитопеничекской пурпуре, других аутоиммунных заболеваниях, а также при тяжелых вирусно-бактериальных инфекциях, сепсисе, для профилактики инфекционных осложнений у недоношенных детей.
Комплексный иммуноглобулиновый препарат (КИП). КИП содержит иммуноглобулины человека трех классов: Ig A (15-25%), Ig M (15-25%) и Ig G (50-70%). От всех других иммуноглобулиновых препаратов, КИП отличает высокое содержание Ig A и Ig M, повышенная концентрация антител к грамотрицательным энтеропатогенным бактериям кишечной группы (шигеллы, сальмонеллы, эшерихии и др.), высокая концентрация антител к ротавирусам, а также пероральный способ применения. КИП используется при острых кишечных инфекциях, дисбактериозах, хронических энтероколитах, аллергодерматозах, сочетающихся с кишечной дисфункцией.
Близким к иммуноглобулиновым препаратам в плане пассивного переноса иммунитета является препарат Аффинолейкин. Он содержит комплекс низкомолекулярных белков лейкоцитарного экстракта человека, способных переносить иммунореактивность к антигенам общераспространенных инфекционных заболеваний (герпес, стафилококк, стрептококк, микобактерии туберкулеза и др.) и афинно связывающихся с ними. Введение Афинолейкина приводит к индукции иммунитета в отношении тех антигенов, иммунологической памятью к которым обладали доноры лейкоцитов. Препарат прошел клинические испытания при лечении простого герпеса, опоясывающего лишая, гепатитов, аденовирусных инфекций в дополнение к основной терапии не давшей ожидаемых результатов.
Дифтерия. Для лечения больных дифтерией в нашей стране выпускается очищенная и концентрированная методом «Диаферм-3» противодифтерийная сыворотка.
В ряде стран Европы и в США для этих целей производится также человеческий противодифтерийный гамма-глобулин. Сыворотку получают из крови гипериммунизированных дифтерийным анатоксином лошадей. Ее доза и методика введения определяются клинической формой заболевания
Ботулизм. Основным препаратом иммунотерапии больных ботулизмом является противоботулиническая лошадиная очищенная и концентрированная сыворотка типов А, В, С, Ей F. Для людей, имеющих аллергию к чужеродному белку (положительная проба на внутрикожное введение раствора сыворотки), может быть использован поливалентный противоботулинический гамма-глобулин отечественного производства, приготовленный из крови доноров, иммунизированных ботулоанатоксинами типов А, В и Е. В 1-й ампуле содержится одна лечебная доза препарата. Противоботулиническая сыворотка выпускается в виде комплектов моновалентных (в упаковке находится по одной ампуле сыворотки каждого типа) или поливалентных (в одной ампуле - антитоксины 3, 4 или 5 типов). В ампуле с моновалентной сывороткой содержится одна лечебная доза антитоксических тел соответствующего типа (для типа А - 10 000 ME, типа В - 5000 ME, типа С - 10 000 ME, типа Е - 10 000 ME, типа F - 300 ME). В каждой ампуле с поливалентной сывороткой находится то же количество антител против всех пяти или трех типов ботулотоксина (антитоксины типов С и F, в связи с ограниченной потребностью в них, обычно в комплект не включаются).
Лечение больных ботулизмом, когда неизвестен тип токсина, вызвавшего заболевание, начинается с применения поливалентного препарата или смеси моновалентных сывороток. Их вводят внутривенно. При затруднениях внутривенного применения сыворотки ее назначают внутримышечно. Обычно вводят 1 - 1,5 лечебной дозы препарата. При тяжелом течении заболевания сыворотки применяют повторно (1-4 раза) с интервалом в 6-8 часов в 1,5 раза большей дозе, чем при среднетяжелой форме болезни. Повторное введение осуществляется внутримышечно.
Если в ранние сроки заболевания установлен тип возбудителя ботулизма, лечение больных осуществляют моновалентной сывороткой.
Продолжительность курса серотерапии определяется клинической формой заболевания и динамикой исчезновения неврологических, сердечно-сосудистых и других нарушений. При легкой форме патологического процесса она, как правило, не превышает 2 сут, а при тяжелой - 4-5 суток.
Столбняк. Для лечения больных столбняком предназначена противостолбнячная очищенная и концентрированная лошадиная сыворотка, а также человеческий противостолбнячный гамма-глобулин.
Сыворотку получают из крови лошадей, иммунизированных столбнячным анатоксином. Ее применяют больным столбняком внутримышечно по 100-200 тыс. ME (в зависимости от тяжести состояния больного). Одновременно с этим 5-10 тыс. ME препарата вводят в ткани, окружающие рану.
При аллергии организма больного к чужеродному белку целесообразно вместо сыворотки применять специфический гамма-глобулин, приготовленный из крови доноров, иммунизированных столбнячным анатоксином.
Препарат назначается с лечебной целью однократно в дозе 6-12 мл внутримышечно.
Стафилококковая инфекция. При стафилококковой инфекции (стафилококковом сепсисе, стафилококковой пневмонии и др.) основным эффективным средством лечения больных являются препараты, содержащие специфические антитела - противостафилококковый иммуноглобулин, противостафилококковая плазма, а также производимый в некоторых странах ближнего зарубежья (Грузия) гетерогенный иммуноглобулин.
Противостафилококковый иммуноглобулин готовят из крови доноров, иммунизированных стафилококковым анатоксином. Препарат выпускают в ампулах по 3-5 мл, в которых содержится 100 ME специфических антител. Разовая (она же суточная) доза противостафилококкового иммуноглобулина при остром стафилококковом сепсисе должна составлять 10 МЕ/кг массы тела (следовательно, для больного массой 70 кг она равна количеству препарата, содержащегося в 7 ампулах). Курс лечения при стафилококковом сепсисе должен продолжаться 8-10 сут, при стафилококковой пневмонии 3-5 сут, при стафилококковом остеомиелите 5-8 сут и более.
В связи с вязкой консистенцией противостафилококкового иммуноглобулина следует его набирать и вводить с помощью толстой иглы.
Противостафилококковая плазма является жидкой частью крови людей, иммунизированных стафилококковым анатоксином. Содержащийся в ней антитоксин (антитела) оказывает выраженный терапевтический эффект при заболеваниях стафилококковой этиологии - сепсисе, пневмонии, остеомиелите, перитоните, а также при локализованных гнойных процессах.
В 1 мл плазмы содержится не менее 6 ME антитоксина.
Противостафилококковая плазма выпускается в замороженном состоянии (в стерильных пластиковых мешках емкостью от 10 до 250 мл) и в высушенном виде (в герметических стеклянных флаконах объемом 250 мл по 125 мл препарата - для внутривенного введения и во флаконах емкостью 10 мл по 2 мл препарата - для местного применения). Замороженную плазму перед употреблением оттаивают в подогретой до 37,0°С воде. Появляющиеся при этом хлопья вскоре растворяются, и плазма становится прозрачной. Появление на дне мешка с плазмой тонкого слоя осадка белого цвета не является противопоказанием для ее использования. Обязательным условием в этом случае является применение системы для переливания лечебных растворов, имеющей фильтр.
Помутнение плазмы, наличие в ней грубого осадка, хлопьев, пленок - свидетельство инфицированности ее и негодности для применения в лечебных целях.
Сухую плазму перед использованием растворяют дистиллированной водой. После этого она не должна содержать хлопьев, сгустков, осадка. Противостафилококковая плазма, как правило, применяется внутривенно. При остром стафилококковом сепсисе ее назначают по 200 мл один раз в 2 дня. При тяжелом течении
Противостафилококковый гетерогенный иммуноглобулин получают из крови лошадей, иммунизированных стафилококковым анатоксином. В 1 мл препарата содержится 800 ME антитоксина. При остром стафилококковом сепсисе назначают по 1-2 мл/сутки иммуноглобулина. Однако он обладает очень высокой реактогенностью и в 1/5 части случаев дает побочные реакции (в основном сывороточную болезнь).
Полиомиелит. Паротит. Для предупреждения осложненного течения этих заболеваний в ранние сроки манифестирования инфекционного процесса применяют нормальный человеческий иммуноглобулин (20 мл внутримышечно).
Препарат производится из плацентарной, абортной венозной крови людей
Заключение
В настоящее время микробиологическая промышленность России и других стран производит иммунные сыворотки и иммуноглобулины для лечения больных различными инфекционными заболеваниями. Это предусмотрено в отношении возбудителей тех болезней, в патогенезе которых первостепенное значение играют экзотоксины (дифтерия, ботулизм, столбняк и др.), а также ряда опасных для здоровья людей болезней - стафилококковой инфекции, сибирской язвы, лептоспироза, гриппа, бешенства, клещевого энцефалита.
Эффективность иммунных сывороток (иммуноглобулинов) в значительной мере определяется оптимальной их дозой и своевременностью применения. Доза препарата должна соответствовать клинической форме инфекционного процесса и быть способной нейтрализовать не только циркулирующие в данный момент в организме антигены возбудителей заболевания, но и те, которые могут появиться в нем в промежуток времени между введениями препарата.
Антимикробный и клинический эффект иммунных сывороток (иммуноглобулинов) тем выше, чем раньше они применяются. Назначение их после 4-5-го дня болезни редко дает выраженный положительный результат.
Гаммаглобулины из крови человека отличаются ареактогенностью. Только у отдельных людей, обладающих чрезвычайно высокой чувствительностью, они могут вызывать кратковременное повышение температуры тела.
Иногда возникает реакция на повторное введение этих препаратов: через 1-3 дня после применения сыворотки развивается зудящая уртикарная сыпь.
Литература
1. Актуальные вопросы эпидемиологии и инфекционных болезней. Семина Н. А. Семина. – М.: Медицина, 1999- 147с.
2. Лисицын Ю.П., Полунина Н.В. Общественное здоровье и здравоохранение: Учебник. М.: 2002 – 216 с.
3. Обуховец Т.П. Основы сестринского дела. Практикум. Серия «Медицина для Вас»– Ростов н/Д: «Феникс», 2002 - 410 с.
4. Руководство по профилактике в практическом здравоохранении. Под ред. Глазунова И.С., Оганова Р.Г. и др. – М.: 2000. – 217 с.
5. Таточенко В. К., Озерецковский Н. А., Иммунопрофилактика: (справочник. - 6-е изд., доп.). М., 2003 - 174с.
4280 0
Пассивная иммунизация происходит через перенос антител или иммунных клеток одному индивидууму от другого, уже непосредственно встречавшегося с антигеном и выработавшего иммунный ответ. Она отличается от активной иммунизации тем, что при ней не полагаются на способность иммунной системы организма выработать соответствующий ответ. Таким образом, пассивная иммунизация с помощью антител приводит к немедленному получению организмом антител для защиты от патогенов. Она может происходить естественным образом, как в случае передачи антител через плаценту или молозиво, так и терапевтическим, когда антитела вводят в качестве профилактики или лечебного средства от инфекционных заболеваний.
Пассивная иммунизация посредством переноса антител через плаценту
Развивающийся плод пассивно иммунизируется с помощью материнских IgG в результате переноса антител через плаценту . Эти тела есть у него в момент рождения. Они защищают новорожденного от инфекций, для которых достаточно наличия IgG и к которым у его матери имеется иммунитет. Например, передача антител к токсинам (столбнячному, дифтерийному), вирусам (кори, полиомиелита, свинки и т.д.), а также некоторым бактериям (Haemophilus influenzae или Streptococcus agalactiae группы В) может обеспечить защиту ребенку в первые месяцы жизни.Таким образом, адекватная активная иммунизация матери является простым и эффективным средством обеспечения пассивной защиты плоду и новорожденному. (Однако некоторые недоношенные новорожденные могут не получить материнских антител в той же мере, как младенцы, рожденные в срок.) Вакцинация анатоксином может вызвать ответ со стороны IgG, которые проходят через плаценту и обеспечивают защиту плоду и новорожденному. Такая защита исключительно важна в тех районах земного шара, где загрязненная окружающая среда может привести к tetanus neonatorum (тетанус у новорожденного, возникающий обычно вследствие инфицирования пуповины).
Пассивная иммунизация через молозиво
Человеческое молоко содержит ряд факторов, которые могут повлиять на ответ организма кормящегося молоком младенца на возбудителей инфекций. Некоторые из них являются естественными селективными факторами и влияют на кишечную микрофлору, а именно способствуют росту необходимых бактерий и действуют как неспецифические ингибиторы для некоторых микробов. На микрофлору также может повлиять действие лизоцима, лактоферрина, интерферона и лейкоцитов (макрофагов, Т-клеток, В-клеток и гранулоцитов). Антитела (IgA) обнаруживаются в грудном молоке, причем их концентрация выше в молозиве (первое молоко), появляющемся непосредственно после родов (табл. 20.6).Таблица 20.6. Уровни содержания иммуноглобулина в молозиве, мг/100 мл
Выработка антител является результатом действия В-клеток, которые стимулируются кишечными антигенами и мигрируют в молочную железу, где вырабатывают иммуноглобулины (этеромаммарная система). Таким образом, микроорганизмы, колонизирующие или инфицирующие пищеварительный тракт матери, могут приводить к выработке антител молозива, которые осуществляют защиту слизистых оболочек кормящегося материнским молоком ребенка от патогенов, поступающих через кишечный тракт.
Было показано наличие антител к энтеропатогенам Escherichia coli, Salmonella typhi, штаммам Shegella, вирусам полиомиелита, Коксаки и эховирусам. Кормление новорожденных с низкой массой тела, не получающих материнское молоко, смесью IgA (73 %) и IgG (26 %), взятых из сыворотки крови человека, защищает их от некротизирующего энтероколита. В молозиве также были обнаружены антитела к непищевым патогенам, например антитоксины к столбняку и дифтерии, а также антистрептококковому гемолизину.
Т-лимфоциты, чувствительные к туберкулину, также передаются новорожденному через молозиво, но роль таких клеток в пассивной передаче клеточно-опосредованного иммунитета неясна.
Пассивная терапия с помощью антител и сывороточная терапия
Назначение препаратов специфических антител было одним из первых методов эффективной антимикробной терапии. Антитела против определенных патогенов вырабатывают у животных, таких как лошади и кролики (гетерологичные антитела), и назначают людям в качестве сывороточной терапии для лечения различных инфекций. Сыворотка людей, излечившихся от инфекций, богата антителами; ее также можно использовать для пассивной терапии с помощью антител (гомологичные антитела).В последние годы для пассивной терапии инфекционных заболеваний с помощью антител использовали некоторые моноклональные антитела, произведенные в лаборатории. В настоящее время исследования в этой области расширились, и похоже, в недалеком будущем возникнут новые методы лечения, основанные на применении антител.
Активным агентом при сывороточной терапии является специфическое антитело. До начала эры антибиотиков (до 1935 г.) сывороточная терапия часто была единственным доступным методом лечения инфекций. Ее использовали для лечения дифтерии, столбняка, пневмококковой пневмонии, менингококкового менингита, скарлатины и других серьезных инфекций. Например, во время Первой мировой войны для лечения раненых британских солдат применяли противостолбнячный антитоксин, который получали от лошадей. Результатом стало быстрое снижение частоты случаев возникновения столбняка. Этот опыт позволил определить минимальную концентрацию антитоксина, необходимую для обеспечения защиты, и показал, что период защиты у человека был достаточно краток. Это объясняется на рис. 20.5 и 20.6.
Рис. 20.5. Концентрация в сыворотке человеческого и лошадиного IgG после введения человеку
Гетерологичные лошадиные антитела у людей разводятся, подвергаются катаболизму, формируют иммунные комплексы и удаляются. Наоборот, гомологичные человеческие антитела, концентрация которых в сыворотке крови достигает максимума примерно 2 сут спустя после подкожной инъекции, разводятся, подвергаются катаболизму и достигают половины максимальной концентрации примерно через 23 сут (период полураспада человеческих IgG1, IgG2 и IgG4 - 23 сут; IgG3 - 7 сут). Таким образом, защитная концентрация человеческих антител в крови сохраняется значительно дольше лошадиных антител.

Рис. 20.6. Человеческий и лошадиный IgG после введения человеку
Гетерологичные антитела, такие как лошадиные, способны вызывать по крайней мере два вида реакций гиперчувствительности: I типа (немедленную, анафилаксия) или III типа (сывороточная болезнь от иммунных комплексов). Если другое лечение недоступно, у индивидуума с I типом чувствительности можно использовать гетерологичную антисыворотку, вводя чужеродную сыворотку и постепенно увеличивая ее количество на протяжении нескольких часов.
Некоторые препараты гетерологичных антител (например, лошадиный дифтерийный антитоксин и антилимфоцитарную сыворотку (antilimphocyte serum - ALS) ) до сих пор используют для лечения людей. За последние годы благодаря достижениям в технологии гибридом и рекомбинантных ДНК мы получили возможность синтезировать человеческие иммуноглобулины для лечения и больше не зависим от животных источников антител для лечения людей. Человеческие антитела обладают значительно более длинным периодом полураспада и пониженной токсичностью.
Моноклональные и поликлональные препараты
Технология гибридом, позволяющая производить моноклональные антитела, была открыта в 1975 г.. Поликлональные препараты получают в результате ответа со стороны антител на иммунизацию или выздоровления организма от инфекции. В целом антитела к специфическому агенту являются только небольшой фракцией всех антител в поликлональном препарате. Более того, поликлональные препараты обычно содержат антитела к многочисленным антигенам и включают антитела различных изотипов. Препараты моноклональных антител отличаются от препаратов поликлональных антител тем, что моноклональные антитела обладают одной специфичностью и одним изотипом.В результате активность препаратов моноклональных антител значительно выше по отношению к общему количеству белка, присутствующего в поликлональных препаратах. Другим преимуществом моноклональных препаратов является то, что они неизменны от партии к партии, что характерно для поликлональных препаратов, количественно и качественно зависящих от иммунного ответа, определяющего их действенность. Однако поликлональные препараты обладают преимуществом: в состав таких препаратов входят антитела различной специфичности и разных изотопов, поэтому они более разнообразны биологически.
За последние 5 лет для клинического использования была лицензирована по крайней мере дюжина моноклональных антител. Большинство из них были разработаны для лечения рака; однако в настоящее время лицензируется моноклональное тело для использования в целях предотвращения инфекций, вызываемых респираторными синцитиальными вирусами у маленьких детей. Некоторые препараты моноклональных и поликлональных антител в настоящее время применяют для лечения людей.
Изготовление иммунного сывороточного глобулина человека и его свойства
Иммуноглобулин сыворотки человека стали применять в начале XX в. Тогда сыворотку от пациентов, излечившихся от кори, вводили контактировавшим с больными детям, симптомы у которых не успели развиться. Другие попытки применения иммуноглобулина в 1916 г. и позднее показали, что раннее применение сыворотки, полученной от людей, излечившихся от кори, может предотвратить появление клинически выраженной болезни. В 1933 г. было также обнаружено, что источником антител против кори может быть человеческая плацента.Проблемой использования сыворотки для пассивной терапии является то, что в большом ее объеме содержится относительно небольшое количество антител. В начале 1940-х гг. Р.Кох с сотрудниками открыли метод выделения фракции гаммаглобулина (у-глобулин) из человеческой сыворотки путем преципитации с помощью холодного этанола. Этот метод, названный фракционированием Коха, представляет собой легко осуществимый и безопасный способ получения гомологичных человеческих антител для клинического использования.
Плазму собирают от здоровых доноров или получают из плаценты. Плазму или сыворотку нескольких доноров собирают в пул. Полученный препарат называется иммунным сывороточным глобулином (immune serum globulin - ISG) или нормальным человеческим иммуноглобулином (human normal immunoglobulin - HNI) .
Если плазму или сыворотку берут у доноров, предварительно специально отобранных после иммунизации или введения бустерных доз антигена, а также у выздоровевших от определенной инфекции, специфический препарат иммуноглобулина обозначается соответствующим образом: противостолбнячный иммуноглобулин (tetanus immune globulin - TIG) , иммуноглобулин против гепатита В (hepatitis В immune globulin - HBIG) , иммуноглобулин против варицеллы-зостер (вируса группы герпеса) (varicella-zoster immuneglobulin - VZIG) , иммуноглобулин против бешенства (rabies immune-globulin - RIG) .
Большое количество иммуноглобулина можно получить с помощью плазмафереза с последующим возвращением клеток крови донору. Фракцию, содержащую иммуноглобулины, получают посредством преципитации с помощью холодного этанола. Полученный препарат: 1) теоретически свободен от вирусов, таких как вирус гепатита и ВИЧ; 2) содержит антитела IgG, концентрация которых повышена примерно в 25 раз; 3) сохраняет стабильность в течение нескольких лет; 4) может обеспечить пиковые уровни содержания в крови приблизительно через 2 сут после внутримышечной инъекции.
Безопасные при внутривенном введении препараты (intravenous immunoglobulin - IVIG или intravenous gammaglobulin - IVGG; в русском переводе - внутривенный иммуноглобулин - ВВИГ) готовят при помощи преципитации холодным этанолом с последующей обработкой несколькими методами: фракционированием с помощью полиэтиленгликоля или обмена ионами; подкислением до рН 4,0 - 4,5; воздействием пепсином или трипсином; стабилизацией с помощью мальтозы, сахарозы, глюкозы или глицина.
Таблица 20.7. Сравнительные характеристики сывороточных иммуноглобулинов
Такая стабилизация уменьшает агрегацию глобулинов, которая может спровоцировать анафилактические реакции. В указанных внутривенных препаратах содержится IgG от 1/4 до 1/3 от количества, применяемого в препаратах для внутримышечного введения. В этих препаратах отмечаются только следы IgA и IgM (табл. 20.7).
Показания к применению иммуноглобулина
Антитела к RhD-антигену (Rhogam) вводят резус-отрицательным матерям в течение 72 ч после родов (перинатальный период) для предотвращения их иммунизации фетальными резус-положительными эритроцитами, которая может повлиять на последующие беременности. Введение Rhogam обеспечивает защиту, содействуя удалению фетальных Rh+-клеток, с которыми мать контактирует во время родов, и таким образом устраняет сенсибилизацию резус-отрицательных матерей резус-положительными антигенами. Антитоксин TIG используется для обеспечения пассивной защиты при некоторых ранениях или в случаях, когда адекватная активная иммунизация с помощью противостолбнячного анатоксина не проводилась.Больным лейкозом, которые особенно чувствительны к вирусу варицелла-зостер, а также беременным женщинам и новорожденным, контактировавшим с заболевшими или инфицированными вирусом ветряной оспы, вводится VZIG. Иммуноглобулин против цитомегаловируса человека (CMV-ВВИГ) вводится профилактически реципиентам трансплантатов почек или костного мозга. Индивидуумам, покусанным животными, у которых есть подозрение на наличие вируса бешенства, вводят RIG, одновременно осуществляя активную иммунизацию человеческой диплоидной клеточной вакциной против бешенства (человеческий RIG имеется не везде, и в некоторых районах могут потребоваться лошадиные антитела).
Препарат HBIG можно вводить новорожденному, у матери которого имеются признаки заражения гепатитом В, а также медицинским работникам после случайного укола иглой для подкожного введения или индивидууму после полового контакта с больным гепатитом В. (Против гепатита В можно также использовать ISG) Иммунный глобулин против вакцинии вводится больным экземой или людям с подавленным иммунитетом, имеющим тесный контакт с теми, кто проходил вакцинацию от ветряной оспы живой аттенуированной вакциной. У таких лиц с подавленным иммунитетом аттенуированные вакцины могут вызвать прогрессирующие деструктивные заболевания.
В некоторых случаях в связи со своими противомикробными свойствами используется ВВИГ. Также его успешно применяют против инфекций, вызванных стрептококками типа В, у недоношенных детей, при хроническом менингоэнцефалите, вызванном эховирусами, и болезни Кавасаки (заболевание неясной этиологии). Внутривенное введение может снизить инфекционную заболеваемость у больных раком крови, таких как В-клеточный лимфолейкоз и множественная миелома Постоянное введение ВВИГ оказалось полезным у детей с подавленным иммунитетом и недоношенных новорожденных.
При гипогаммаглобулинемии и первичном иммунодефиците необходимо повторно вводить ISG. Терапевтическую ценность при различных аутоиммунных заболеваниях представляет и ВВИГ. Например, при иммунной идиопатической тромбоцитопенической пурпуре ВВИГ предположительно блокирует Fc-pe-цепторы на фагоцитарных клетках и препятствует фагоцитозу и разрушению тромбоцитов, покрытых аутоантителами. С различной степенью успеха ВВИГ использовали и при других иммунных цитопениях.
Предосторожности при иммунотерапии
Отличные от ВВИГ препараты нужно вводить внутримышечно. Внутривенное введение противопоказано в связи с возможностью анафилактической реакции. Это, по-видимому, обусловлено агрегатами иммуноглобулинов, сформировавшихся во время их разделения на фракции во время преципитации, проводимой с помощью этанола Эти агрегаты активируют комплемент с получением анафилатоксинов (IgG1, IgG2, IgG3, IgM - по классическому пути, a IgG и IgA - по альтернативному пути) или прямо перекрестно связывают Fc-рецепторы, приводя к высвобождению медиаторов воспаления. Применение безопасного для внутривенного введения ВВИГ получило широкое распространение особенно в тех случаях, когда необходимы повторные инъекции (агаммаглобулинемия).Одним из особых противопоказаний для введения препаратов иммуноглобулина является наличие врожденного дефицита IgA. Поскольку у таких больных отсутствует IgA, они распознают его как чужеродный белок и отвечают на него производством антител, в том числе антител IgE, что может приводить к последующей анафилактической реакции. Препараты ВВИГ, содержащие только следы IgA, вызывают меньше проблем.
Колониестимулирующие факторы
Колониестимулирующие факторы (КСФ) являются цитокинами, стимулирующими развитие и созревание всех лейкоцитов. Гранулоцитарный (Г-КСФ), гранулоцитарно-макрофагальный (ГМ-КСФ) и макрофагальный (М-КСФ) колониестимулирующие факторы были клонированы с помощью технологии рекомбинантных ДНК и теперь доступны для клинического применения. Эти КСФ доказали свою пользу, ускоряя восстановление клеток костного мозга у пациентов, у которых при лечении рака или пересадке органов подавлялись миелоидные клетки.У таких пациентов истощение нейтрофилов (нейтропения) является основным фактором, предрасполагающим к развитию тяжелых инфекций. Сокращая период нейтропении, КСФ уменьшает частоту появления тяжелых инфекций у этих пациентов. Такие КСФ улучшают также функцию лейкоцитов; есть предварительная обнадеживающая информация, что эти белки могут быть полезны в процессе иммунотерапии для усиления защиты организма от различных патогенов.
Некоторые другие цитокины являются мощными активаторами иммунной системы: весьма интересно изучить, как их можно применять в качестве средства дополнительной терапии при лечении инфекционных болезней. Также мощным активатором функции макрофагов является IFNy. Было показано, что он уменьшает частоту развития тяжелых инфекций у пациентов с врожденным дисфагоцитозом (нарушение переваривания фагоцитированных бактерий ПМЯ-лейкоцитами). Интерферон-у дал обнадеживающие результаты в качестве средства дополнительной терапии при некоторых инфекциях, таких как инфекция, вызванная резистентными к лекарствам штаммами Mycobacterium tuberculosis, и редкие грибковые инфекции.
Выводы
1. Чтобы вызвать заболевание, микроорганизм должен повредить макроорганизм .2. Эффективная защита организма от отдельного патогена зависит от типа этого патогена. Обычно успешная защита от большинства патогенов зависит от гуморального и клеточного компонентов врожденной и адаптивной иммунной систем.
3. Патогены применяют различные стратегии ускользания от защитных сил организма, например использование полисахаридных капсул, антигенное разнообразие, выработку протеолитических ферментов и активное подавление иммунного ответа.
4. Эффективный ответ организма на патоген включает компоненты гуморального и клеточного иммунитета. Однако в отношении некоторых патогенов защиту организма может обеспечивать преимущественно одна из ветвей иммунной системы.
5. Защиты от инфекционных заболеваний можно достигнуть посредством как активной, так и пассивной иммунизации.
6. Активная иммунизация может быть следствием перенесенной инфекции или вакцинации. Пассивная иммунизация может происходить естественным (таким как перенос антител от матери плоду через плаценту или новорожденному - через молозиво) или искусственным путем (таким как введение иммунных глобулинов).
7. Активная иммунизация может осуществляться путем введения одного иммуногена или их комбинации.
8. Инкубационный период заболевания и скорость, с которой количество антител достигает защитных уровней, влияют как на эффективность иммунизации, так и на анамнестический эффект бустерной инъекции.
9. Место введения вакцины может иметь большое значение. Многие способы иммунизации приводят к преимущественному синтезу сывороточных IgM и IgG, а введение некоторых вакцин через рот - к появлению секреторного IgA в пищеварительном тракте.
10. Благодаря иммунопрофилактике организм легче справляется с последующей инфекцией; иммунотерапия характеризуется ограниченной эффективностью при инфекционных заболеваниях.
Р.Койко, Д.Саншайн, Э.Бенджамини
Пассивная иммунизация - введение антител к каким-либо антигенам. С помощью пассивной иммунизации можно создать только временный иммунитет продолжительностью 1- 6 нед. Хотя пассивная иммунизация вызывает кратковременное повышение устойчивости к возбудителю, ее действие проявляется немедленно. Повторная пассивная иммунизация не усиливает иммунитет и часто сопровождается осложнениями. К пассивной иммунизации прибегают для создания временного иммунитета после контакта с возбудителем инфекции в тех случаях, когда активная иммунизация по тем или иным причинам не проводится заранее (например, против цитомегаловируса, против бешенства). Пассивную иммунизацию применяют также для лечения заболеваний, вызванных бактериальными токсинами (в частности, дифтерии), укусов ядовитых змей, укусов пауков и для специфической (анти-Rh0(D)-иммуноглобулин) и неспецифической (антилимфоцитарный иммуноглобулин) иммуносупрессии.

Для пассивной иммунизации пользуются тремя видами препаратов: - нормальными человеческими иммуноглобулинами (устаревшее название - гамма-глобулин) для в/м или в/в введения; - специфическими человеческими иммуноглобулинами с высоким содержанием антител против определенных возбудителей (например, против вируса гепатита В или против вируса varicella-zoster); - специфическими сыворотками, в том числе антитоксическими, полученными от иммунизированных животных.

По происхождению различают гомологичные (изготовленные из сыворотки крови человека) и гетерологичные (из крови гипериммунизированных животных) препараты. Первые препараты вводят сразу в полной дозе, вторые - по методу Безредки. Вначале внутрикожно вводят 0,1 мл разведенной 1:100 нормальной лошадиной сыворотки и наблюдают за реакцией в течение 20 мин. Проба считается положительной, если диаметр папулы достигает 1 см и более. При отрицательном результате внутрикожной пробы введение сывороток начинают с подкожной инъекции 0,1 мл, и если в течение 30 мин какие-либо реакции отсутствуют, то вводят внутримышечно остальное количество сыворотки. При положительной внутрикожной пробе сыворотку вводят только по безусловным показаниям, т. е. при угрозе жизни больного. При этом вначале вводят подкожно разведенную сыворотку, применяемую для постановки внутрикожной пробы с 20-минутными интервалами в дозах 0,5, 2,0 и 5,0 мл, что приводит к десенсибилизации. Если реакция на эти дозы отсутствует, то вводят подкожно 0,1 мл неразведенной гипериммунной сыворотки, затем через 30 мин - всю назначенную дозу. В случае появления реакции на одну из доз лечебной сыворотки ее вводят над наркозом, имея наготове шприц с адреналином или эфедрином. По направленности действия препараты разделяют на антитоксические, антивирусные и антибактериальные.

Антивирусные Гомологичные иммуноглобулины антирабический антиротавирусный против гепатита В противогриппозный против клещевого энцефалита против цитомегаловируса Гетерологичные иммуноглобулины антирабический против венесуэльского энцефаломиелита лошадей против клещевого энцефалита против лихорадки Эбола против японского энцефалита

Антибактериальные Гомологичные иммуноглобулины комплексный иммуноглобулиновый препарат (КИП). КИП представляет собой лиофилизированный белковый раствор, содержащий иммуноглобулины классов IgG, IgA, IgM, выделенные из плазмы крови человека. Гетерологичные иммуноглобулины лактоглобулин колипротейный противолептоспирозный противосибиреязвенный


Иммунные сыворотки Иммунные сыворотки - препараты из крови животных и человека, содержащие антитела против возбудителей инфекционных заболеваний или продуктов их жизнедеятельности. В процессе приготовления И.С. сыворотка крови иммунизированных определёнными антигенами животных или людей (доноров) либо переболевших подвергается различной, в зависимости от типа и назначения И.С, обработке: очистке, при которой удаляются балластные вещества и выделяются активные, прежде всего глобулиновые, фракции белков. Введение человеку иммунной сыворотки из крови животных может сопровождаться осложнениями (сывороточная болезнь, анафилактический шок). Концентрированные иммунные сыворотки - гамма-глобулины из крови человека - практически не вызывают этих осложнений и медленнее выводятся из организма. В зависимости от назначения различают лечебно- профилактические и диагностические иммунные сыворотки. Лечебно- профилактические иммунные сыворотки подразделяют на антитоксические - против ядовитых продуктов жизнедеятельности микробов (например, противостолбнячная, противодифтерийная, противогангренозная) и против последствий укуса ядовитых змей и насекомых; антибактериальные - воздействующие на микроорганизм (противосибиреязвенный гамма-глобулин) и антивирусные (например, противокоревой, антирабический, противогриппозный гамма-глобулины).

Иммуноглобулины Данный тип иммунных препаратов содержат антитела в готовом виде. Их применяют с лечебной, профилактической целями, а также для проведения экстренной профилактики инфекционных заболеваний. Иммуноглобулины могут иметь противомикробное, противовирусное или антитоксическое действие. Иммуноглобулин получают из плацент или донорской крови. Последний более очищенный и не содержит гормональных веществ. Положительные стороны применения иммуноглобулинов - в организм вводится готовый набор антител в достаточной дозе в течение короткого промежутка времени. В то же время, препарат сравнительно быстро разрушается, подавляет синтез собственного иммуноглобулина, аллергизирует организм.

Иммуноглобулин нормальный человеческий (противокоревой) готовят из сыворотки крови доноров, а также плацентарной и абортной крови. Он содержит в достаточно высокой концентрации антитела против вируса кори, в различных концентрациях антитела против возбудителей гриппа, ветряной оспы, полиомиелита, краснухи, коклюша, дифтерии и многих других бактериальных и вирусных инфекций, потому что готовят его из смеси большого числа сывороток взрослых людей, которые в течение жизни могли перенести различные заболевания или подвергнуться различным видам вакцинации.

Иммуноглобулины направленного действия готовят из крови людей, специально иммунизированных против конкретных инфекционных заболеваний, а также путем отбора крови тех доноров, у которых определяют повышенное содержание антител к определенному возбудителю без предварительной иммунизации.

Противостолбнячный иммуноглобулин Иммуноглобулин человека противостолбнячный представляет собой концентрированный раствор очищенной фракции иммуноглобулинов, выделенной методом фракционирования этиловым спиртом из плазмы крови доноров, иммунизированных столбнячным анатоксином. Действующим началом препарата являются иммуноглобулины класса G, обладающие активностью антител, нейтрализующих столбнячный токсин. Максимальная концентрация антител в крови достигается через часов после введения; период полувыведения антител из организма составляет 3-4 недели.

Антистафилококковая плазма Получают на станциях переливания крови от доноров, иммунизированных стафилококковым анатоксином. После проведенной иммунизации и появления в крови специфических антител в титре 6,0 – 10 МЕ/л донорам проводится плазмаферез. В ходе плазмафереза из организма извлекается порция крови, которая затем разделяется на плазму и форменные элементы, клетки крови возвращаются в организм, а удаленная плазма используется.