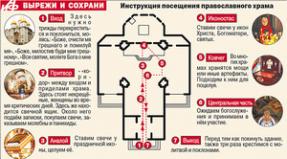
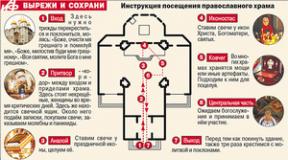
Ишемическая болезнь сердца этиология патогенез классификация. Клиника, патогенез, этиология, классификация ибс и им
ИБС – острая или хроническая дисфункция миокарда вследствие относительного или абсолютного уменьшения снабжения миокарда артериальной кровью, чаще всего связанная с патологическим процессом в системе коронарных артерий (КА).
Этиология ИБС:
1. Атеросклероз КА – чаще поражается передняя нисходящая ветвь левой КА, реже – огибающая ветвь левой КА и правая КА.
2. Врожденные аномалии КА (отхождение огибающей артерии от правого коронарного синуса или правой коронарной артерии и др.)
3. Расслаивание КА (спонтанное или вследствие расслаивания аневризмы аорты)
4. Воспалительные поражения КА (при системных васкулитах)
5. Сифилитический аортит с распространением процесса на КА
6. Лучевой фиброз КА (после облучения средостения при лимфогранулематозе и др. опухолях)
7. Эмболия КА (чаще при ИЭ, МА, реже – при ревматических пороках)
В настоящее время ИБС считается ишемия миокарда, вызванная только атеросклеротическим процессом в КА.
Факторы риска ИБС:
а. Модифицируемые : 1) курение сигарет 2) артериальная гипертензия 3) сахарный диабет 4) низкий ХС ЛПВП, высокий ХС ЛПНП, общий ХС выше 6,5 ммоль/л 5) ожирение
б. Немодифицируемые : 1) возраст: 55 лет и старше у мужчин, 65 лет и старше у женщин 2) мужской пол 3) семейная отягощенность по ИБС
Также выделяют основные (возраст старше 65 лет для женщин и старше 55 лет для мужчин, курение, общий ХС > 6,5 ммоль/л, семейная отягощенность по ИБС) и прочие (низкий ХС ЛПВП, высокий ХС ЛПНП, нарушение толерантности к глюкозе, ожирение, микроальбуминурия при СД, малоподвижный образ жизни, повышение уровня фибриногена) факторы риска ИБС.
Патогенез ИБС.
В норме между доставкой кислорода к кардиомиоцитам и потребностью в нем имеется четкое соответствие, обеспечивающее нормальный метаболизм и функции клеток сердца. Коронарный атеросклероз вызывает:
а) механическую обструкцию КА со снижением перфузии клеток
б) динамическую обструкцию КА - коронароспазм – из-за повышенной реактивности пораженных атеросклерозом КА к действию вазоконстрикторов (катехоламинам, серотонину, эндотелину, тромбоксану) и сниженной реактивности к действию вазодилататоров (эндотелиальному релаксирующему фактору, простациклину)
в) нарушение микроциркуляции – из-за склонности к образованию нестойких тромбоцитарных агрегатов в пораженных КА при выделении ряда БАВ (тромбоксана А 2 и др.), которые часто подвергаются спонтанной дезагрегации
г) коронаротромбоз – в области повреждения атеросклеротической бляшки на тромбогенном субэндотелии формируются тромбы, потенцирующие ишемию
Все вышеперечисленное приводит к дисбалансу между потребностью миокарда в кислорода и его доставкой, нарушению перфузии сердца и развитию ишемии с последующими клиническими проявлениями в виде ангинозной боли, ИМ и др.
Классификация ИБС:
1. Внезапная коронарная смерть (первичная остановка кровообращения).
2. Стенокардия:
а) стенокардия напряжения: 1) впервые возникшая (до 1 мес); 2) стабильная (больше 1 мес); 3) прогрессирующая
б) спонтанная (вазоспастическая, особая, вариантная, стенокардия Принцметала)
3. Инфаркт миокарда: а) с Q-зубцом (крупноочаговый – трансмуральный и нетрансмуральный) б) без Q-зубца (мелкоочаговый)
4. Постинфарктный кардиосклероз (через 2 мес после ИМ)
5. Нарушения сердечного ритма
6. Сердечная недостаточность
7. Безболевая («немая») ишемия
8. Микроваскулярная (дистальная) ИБС
9. Новые ишемические синдромы (оглушение миокарда, гибернация миокарда, ишемическое прекондиционирование миокарда)
Некоторые клинические формы ИБС - впервые возникшая стенокардия, прогрессирующая стенокардия, стенокардия покоя и ранняя постинфарктная стенокардия (первые 14 дней после ИМ) - являются формами нестабильной стенокардии .
Лечение – см. вопрос 20.
20. Ишемическая болезнь сердца: стенокардия. Этиология, патогенез, клинические варианты, дифференциальная диагностика. Тактика ведения больных, принципы лечения. Медико-социальная экспертиза. Реабилитация.
Стенокардия – заболевание, характеризующееся приступами загрудинных болей, возникающими в ответ на повышение кислородно-метаболической потребности миокарда вследствие физического или эмоционального напряжения; это синдромное понятие , клинически характеризующееся рядом признаков :
1) условия возникновения боли – физическая нагрузка или эмоциональное напряжение, выход на холодный воздух
2) характер болевых ощущений – сжимающий, жгучий, давящий
3) локализация боли – загрудинная область или предсердечная область слева от грудины
4) иррадиация боли – в левую руку по ульнарному краю к мизинцу, в левую лопатку, нижнюю челюсть
5) продолжительность болевых ощущений – 2-3 минуты, но не более 10-15 мин; исчезают после уменьшения или прекращения физической нагрузки
6) боль быстро и полно купируется после приема нитроглицерина через 3-5, но не более чем через 10 мин
Основные клинические формы стенокардии и их характеристика.
1. Стенокардия напряжения:
а) впервые возникшая – давность заболевания до 1 мес; характеризуется полиморфностью течения – может регрессировать, перейти в стабильную стенокардию или принять прогрессирующее течение, поэтому требует усиленного наблюдения и лечения
б) стабильная (с указанием функионального класса) – давность заболевания более 1 мес; характерны стереотипные боли в ответ на обычную для даннорго больного нагрузку
в) прогрессирующая – формируется чаще на фоне стабильности; характерны нарастающие по частоте, продолжительности и интенсивности ангинозные приступы с резким уменьшением переносимости больными физических нагрузок, с расширением зоны локализации, путей иррадиации болей и ослаблением эффекта от приема нитроглицерина.
2. Спонтанная (особая) стенокардия – характерны приступы ангинозных болей, возникающие без видимой связи с факторами, ведующими к повышению потребности миокарда в кислороде; у большинства больных болевой синдром развивается в строго определенное время суток (чаще ночью или в момент пробуждения), структурно состоит из цепочки 3-5 болевых эпизодов, чередующихся с безболевыми паузами
3. Безболевая («немая») стенокардия – диагностируется при выявлении четких ишемических изменений на ЭКГ в процессе суточного мониторирования или проведения нагрузочных проб, не проявляющихся клиническими признаками
4. Микроваскулярная стенокардия (синдром Х) – характерна типичная клиническая картина стенокардии, выявление ишемии на ЭКГ при нагрузочных или фармакологических пробах при неизмененных КА по данным коронарографии; обусловлена дефектной эндотелийзависимой вазодилатацией мелких миокардиальных артериол, что приводит к снижению резерва коронарного кровотока и ишемии миокарда
Диагностика стенокардии.
1. Данные анамнеза (условия возникновения болей) и характерная клиническая картина.
2. ЭКГ: в покое и во время приступа, Холтеровское мониторирование – специфическим для стенокардии является дислокация сегмента ST на 1 мм вниз (субэндокардиальная ишемия) или вверх (трансмуральная ишемия) от изолинии, чаще всего регистрируемая в момент приступа
3. Нагрузочные тесты: ВЭП, тредмил, чрезпищеводная кардиостимуляция (в ответ на повышение ЧСС возникают ишемические повреждения на ЭКГ), фармакологические пробы с добутамином и изадрином (вызывают повышение потребности миокарда в кислороде), дипиридамолом и аденозином (вызывают синдром обкрадывания, расширяя прежде всего интактные сосуды) - позволяют выявить ишемию миокарда, не определяемую в покое, установить степень выраженности коронарной недостаточности.
Признаки ишемии миокарда во время нагрузочного тестирования:
а) возникновение приступа стенокардии
б) депрессия или элевация сегмента ST горизонтального или косонисходящего типа на 1 мм и более продолжительностью не менее 0,8 сек от точки j
в) увеличение амплитуды зубца R в сочетании с депрессией сегмента ST
4. Радионуклидная сцинциграфия миокарда с 201 Тl (поглощается нормальным миокардом пропорционально коронарной перфузии) или 99 m Tc (избирательно накапливается в зонах некроза миокарда)
5. Эхо-КГ (в т.ч. стресс-Эхо-КГ, Эхо-КГ с фармакологическими пробами) – позволяет оценить локальную и большую сократимость миокарда (нарушение локальной сократимости соответствует очагу ишемии)
6. Коронарография – «золотой стандарт» для диагностики ИБС; выполняется чаще для решения вопроса о целесообразности хирургического лечения
7. Электрокардиотопография – ЭКГ-картирование по 60 отведениям
8. Позитронно-эмиссионнная томография – позволяет получить информацию о коронарном кровотоке и жизнеспособности миокарда
9. Обязательные лабораторные обследования: ОАК, ОАМ, сахар крови, БАК (липидограмма, электролиты, кардиоспецифические ферменты: КФК, АСТ, ЛДГ, миоглобин, тропонин Т), коагулограмма.
Функциональные классы стенокардии позволяют оценить функциональное состояние больных ИБС и переносимость ими физических нагрузок.
18849 0
ИБС - несоответствие коронарного кровотока метаболическим нуждам миокарда, т.е. объему потребления миокардом кислорода (ПМО 2). (Рис. 1).
Рис. 1. Диаграмма баланса доставляемой и потребляемой энергии и факторов, определяющих их уровни
Эквивалентом работоспособности сердца как насоса является уровень ПМО 2 , доставка которого обеспечивается коронарным кровотоком (Qкор). Величина коронарного кровотока регулируется тоническим состоянием коронарных сосудов и разницей давления в восходящем отделе аорты и полости левого желудочка, которое соответствует внутримиокардиальному давлению (напряжению):

Р 1 - давление в восходящем отделе аорты,
Р 2 - давление в левом желудочка (внутримиокардиальное напряжение),
R кор - сопротивление коронарных сосудов.
Энергетическое обеспечение насосной функции сердца в широком диапазоне его деятельности - от состояния покоя до уровня максимальной нагрузки происходит за счет коронарного резерва. Коронарный резерв - способность коронарного сосудистого русла во много раз увеличивать коронарный кровоток адекватно уровню ПМО 2 , за счет дилатации коронарных сосудов. (Рис.2).
Величина коронарного резерва (I) в зависимости от давления в коронарных сосудах заключена между прямой, соответствующей коронарному кровотоку при максимально дилатированных сосудах (А, Б), и кривой величины коронарного кровотока при нормальном сосудистом тонусе (область ауторегуляции). В обычных условиях при интактных коронарных артериях сердце находится в ситуации «суперперфузии», т.е. доставка О 2 несколько превышает уровень ПМО 2 .

Рис. 2. Диаграмма коронарного резерва и его динамика в зависимости от различных патологических состояний ССС.
Из диаграммы видно, что коронарный резерв может меняться в сторону увеличения или уменьшения в зависимости от физиологических условий или патологии со стороны коронарных сосудов, крови, массы миокарда. У человека в покое коронарный кровоток в сердечной мышце составляет величину 80-100 мл/100г/мин и при этом поглощается О 2 около 10мл/100г/мин.
При поражении коронарных артерий атеросклерозом или в результате воспалительных изменений сосудистой стенки, способность последних к максимальной дилатации (расширению) резко снижена, что влечет за собой снижение коронарного резерва.
И наоборот, при увеличении массы миокарда (гипертрофия левого желудочка - АГ, гипертрофическая кардиомиопатия) или снижении уровня гемоглобина, носителя О 2 , для адекватного обеспечения ПМО 2 , необходимо увеличение коронарного кровотока в области ауторегуляции (перемещение кривой ауторегуляции вверх), что ведет к уменьшению коронарного резерва (II), особенно при атеросклеротическом поражении коронарных сосудов (Б - снижение прямой, характеризующей дилатационную способность). В общих чертах диаграмма коронарного резерва дает представление о механизмах, обеспечивающих соответствие между меняющимися уровнями ПМО 2 в зависмости от интенсивности сердечной деятельности и величиной доставки О 2 .
Острая коронарная недостаточность - остро возникшее несоответствие между доставкой О 2 , определяемое величиной коронарного кровотока, и уровнем ПМО 2 . (Рис. 3).
Это несоответствие может быть следствием различных причин:
1 - резкое падение коронарного кровотока в результате тромбообразования, спазма (полной или частичной окклзии) коронрных артерий на фоне нормальной величины ПМО 2 ;
2 - экстермальное повышение ПМО 2 , превышающее величину коронарного резерва;
3 - ограниченность коронарного резерва при физиологическом повышении уровня ПМО 2 ;
4 - разнонаправленность изменений величины коронарного кровотока (уменьшение) и уровня ПМО 2 (увеличение).

Рис. 3. Диаграмма соотношений величин потребления миокардом кислорода (ПМО 2) и объемом коронарного кровотока (Q)
По началу развития острой корорнарной недостаточности можно выделить факторы, влияющие на уровень ПМО 2 , и на величину коронарного кровотока; по этиологии - коронарогенные, миокардиальные, экстракардиальный факторы.
Безусловно, подобное деление носит условный характер, так как в условиях целостного организма в той или иной степени имеет место участие всех факторов.
Исследования на животных продемонстрировали, что ишемизированный или гипертрофированный миокард более чувствителен, чем миокард здорового сердца, даже к незначительному снижению уровня гемоглобина. Этот негативный эффект анемии на работу сердца был также отмечен и при проведении исследований у пациентов. Одновременно, снижение уровня гемоглобина сопровождается уменьшением оксигенации крови в легком, что также способствует уменьшению доставки кислорода к миокарду.
Клинические наблюдения указывают, что при сниженном коронарном резерве может формироваться ишемическая, хроническая дисфункции миокарда (систолодиастолическая) даже на фоне нормального объема коронарного кровотока в покое.
Совсем недавно в число общепринятых клинических форм ИБС входили:
1 - стенокардия покоя и напряжения,
2 - нестабильная стенокардия,
3 - острый коронарный синдром (прединфарктное состояние),
4 - инфаркт миокарда; которые с позиций сегодняшнего понимания патологических процессов при ишемической атаке не могут объяснить ряд состояний, с которыми сталкиваются в клинике врачи общей практики, кардиологи и, в особенности, кардиохирурги.
В настоящее время, на основании данных полученных при патофизиологических исследованиях в эксперименте и клинических наблюдениях, с позиций клеточных - субклеточных и молекулярных механизмов функционирования кардиомиоцитов, сформулировано современное понимание «новых ишемических синдромов» - «оглушенный миокард» («Муосаdil Stunning»), «гибернирующий - уснувший миокард» («Муосаdil Hybernatin»), «прекондиционирование» («Preconditioning»), «прекондиционирование - второе окно защиты» («Second Window Of Protection - SWOP»).
Впервые, термин «новые ишемические синдромы», объединяющий выше описанные состояния миокарда после различных эпизодов ишемии, отображающих адаптивные-дезадаптивные изменения метаболизма и сократительного состояния кардиомиоцитов, предложил южноафриканский кардиолог L.H. Opie в 1996 году на рабочей встрече Международного Кардиологического Общества в Кейптауне, под эгидой Совета по молекулярной и клеточной кардиологии.
L.H. Opie подчеркивает, что - «у больных ИБС нередко клиническая картина заболевания характеризуется 9-10 клиническими синдромами, которые обусловлены гетерогенностью причин и разнообразием адаптационных механизмов.
Учитывая гетерогенность проявления ишемического эпизода, непредсказуемость развития и функционирования коллатерального кровообращения в миокарде, как первого этапа защиты миокарда, при остановки кровообращения в коронарном регионе, можно предположить невозможность существования даже двух одинаковых больных, у которых патофизиология и клиническое течение заболевания были бы абсолютно одинаковы. У одного и того же больного могут сочетаться и формироваться различные адаптивные механизмы «новых ишемических синдромов».
В 1996 году RW. Hochachka с коллегами высказали мысль, что жизнеспособность миокарда в условиях ишемии обеспечивается адаптацией к гипоксии, которую можно разделить на два этапа в зависимости от длительности ишемической «атаки» - кратковременную защитную реакцию и фазу «выживания».
С точки зрения современного понимания патофизиологических процессов это выглядит следующим образом. При переходе на анаэробный гликолиз, на этапе кратковременного периода адаптации, происходит истощение запасов макроэргических фосфатов (АТФ, КрФ) в миокарде, которые всегда не велики. Это сопровождается в первую очередь нарушением диастолической фазы расслабления кардиомиоцита и, как следствие, снижение сократительной функции миокарда в области ишемии.
В физиологических условиях 10% АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепление глюкозы до пирувата). Этого количества АТФ, образующегося в результате аэробного гликолиза, не хватает для обеспечения работы ионных кальциевых, натриевых и калиевых каналов сарколеммы и, в частности, кальциевого насоса саркоплазматического ретикулума (СПР).
Восполнение остального количества энергии для функционирования кардиомиоцита при нормальном кислородном обеспечении происходит за счет окисления свободных жирных кислот (СЖК), распад которых при окислительном фосфорилировании обеспечивает до 80% АТФ. Однако СЖК по сравнению с глюкозой - менее эффективный источник АТФ - «топлива» для сердца - насоса, так как при их окислении на выработку одного и того же количества АТФ требуется примерно на 10% больше кислорода. Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних, приводит к тому, что при ишемии (резкое падение доставки кислорода) в митохондриях кардиомиоцитов накапливается большое количество недоокисленных активных форм ЖК, что еще больше усугубляет разобщение окислительного фосфорилирования. (Рис.4).
Недоокисленные активные формы ЖК, в частности - ацилкарнитин, ацилКоА, как метаболиты блокируют транспорт АТФ от места синтеза в митохондриях к месту их потребления внутри клетки. Кроме того, повышенная концентрация этих двух метаболитов в митохондриях оказывает разрушительное действие на мембрану последней, что еще больше ведет к дефициту энергии, необходимой для жизнедеятельности кардиомиоцита. Параллельно, в клетке на фоне анаэробного обмена происходит накопление избыточного количества протонов (Na + , Н +), т.е. происходит ее «закисление».
Далее Na + , Н + обмениваются на другие катионы (преимущественно на Са ++), следствием чего происходит перегрузка миоцитов Са ++ , участвующего в формировании контрактурного сокращения. Избыточное количество Са ++ , снижение функциональной способности кальциевого насоса СПР (дефицит энергии) приводят к нарушению диастолического расслабления кардиомиоцита и развитию контрактуры миокарда.
Таким образом, переход на анаэробный окислительный процесс сопровождается активированием ЖК (длинноцепочечный цетилкарнитин и ацилКоА), которые способствуют разобщению окислительного фосфорилирования, накоплению избыточного количества Са ++ в цитозоле, снижению сократительной способности миокарда и развитию контрактуры с «адиастолией». (Рис.5).

Рис. 4. Схема распределение баланса энергии в кардиомиоците при анаэробном обмене

Рис. 5. Схема перегрузки кардиомиоцитов Са при восстановлении коронарного кровотока.
Фаза выживания - это этап самосохранения миокарда в условиях длительной ишемии. К наиболее значимым приспособительным реакциям миокарда в ответ на ишемию относятся так называемы «новые ишемические синдромы»: гибернация, оглушенность, прекондициснирование, прекондиционирование - второе окно защиты.
Термин «оглушенность» миокарда впервые ввели G.R. Heidricx с соавторами в 1975 году; понятие «гибернация » в 1985 году описал S.H. Rahimatoola; «прекондиционирование » - СЕ. Murry с сотрудниками предложили в 1986 году, а «преондиционирозание - второе окно » - одновременно M.S. Marber с сотрудниками и Т. Kuzuya с соавторами в 1993 году.
Оглушенность (Stunning) миокарда - феномен постишемической дисфункция миокарда в виде нарушения процессов расслабления-сокращения, клинически выражающихся в виде угнетения насосной деятельности сердца, и сохраняющихся после восстановления коронарного кровотока в течении нескольких минут или дней.
В эксперименте на животных, короткий промежуток времени ишемической атаки (остановка кровотока) от 5 до 15 минут не приводит к развитию некроза миокарда, однако ишемия длящаяся не менее 5 минут (типичный ангинозный приступ) ведет к снижению сократительной функции на протяжении последующих 3-х часов, а ишемический приступ в течение 15 минут (без некроза сердечной мышцы) удлиняет период восстановления сократительной функции до 6 часов и более (Рис. 6).
Подобное состояние миокарда в ответ на ишемические эпизоды имеют место в 4 ситуациях:
1 - в пограничных слоях с некрозом сердечной мышцы;
2 - после временного повышения ПМО 2 в участках, кровоснабжаемых частично стенозированной коронарной артерией;
3 - после эпизодов субэндокардиальной ишемии во время чрезмерной физической нагрузки при наличии гипертрофии миокарда левого желудочка (нормальные коронарные артерии);
4 - ситуация - «ишемия-реперфузия» (гипоксия сердечной мышцы с последующей реоксигенацией).

Рис. 6. График восстановления сократительной способности миокарда в зависимости от длительности ишемии.
Длительность окклюзии коронарной артерии не менее 1 часа сопровождается «тяжелым повреждением (maimed) миокарда » или «хронической оглушенностью », что манифистируется восстановлением насосной функции сердца после 3-4 недель.
Типичным клиническим проявлением оглушенности миокарда - ощущение «тяжелого, каменного сердца», в основе которого лежит нарушение диастолы левого желудочка - «неэффективная диастола».
В настоящее время в формировании этого феномена главенствуют две теории патофизиологических процессов: А - образование избыточного количества свободных кислородных радикалов при реперфузии, с активацией перекисного окисления липидов; Б - неуправляемое вхождение Са ++ и его избыточное накопление в кардиомиоците, в результате повреждения сарколеммы перекисным окислением липидов после реперфузии.
Г.И. Сидоренко, суммируя результаты клинических наблюдений, выделяет 4 клинических варианта оглушенности миокарда в зависимости от первопричины нарушения соответствия ПМ0 2 к величине коронарного кровотока (Q ко p № ПМО 2): предсердная - посттахикардиомиопатическая, микроваскулярная и синдром не восстановленного кровотока - «по-reflow».
Предсердное оглушение возникает в период после кардиоверсии, посттахикардиомиопатия - состояние сопровождающееся снижением насосной функции сердца после восстановления нормосистолии; микроваскулярная дисфункция - это сниженная компетентность микроциркуляции за счет неэффективной (неполной) коронарной реканализации; синдром «по-reflow» - невосстановление кровотока на уровне микроцеркуляции (I стадия ДВС - тромботическая).
Механизм развития «оглушения» миокарда до конца не изучен: ведущими в патогенезе «Stunning» являются, по крайней мере, три фактора: образование избыточного количества АФК, постперфузионная кальцевая перегрузка кардиомиоцитов, снижение чувствительности миофибрилл к кальцию.
Показано, что приблизительно в 80% случаев формирования феномена «гибернации миокарда» обусловлено действием АФК, в 20% - кальциевой перегрузкой, которая реализуется через последовательное включение Na + /H + и Na + /Ca ++ обменников. Возможно участие АФК в формировании кальцевой перегрузки через повреждение белков, участвующих в внутриклеточной кинетике (транспорте) Са ++ . В свою очередь кальциевая перегрузка миоплазмы может активировать кальпины - ферменты, вызывающие протеолиз миофибрилл. Необходимость ресинтеза новых миофилламентов является одним из факторов определяющих длительность восстановления сократительной функции кардиомиоцитов.
Обратимые повреждения миокарда, вызванные накоплением в миокарде свободных радикалов, при состоянии оглушении миокарда проявляются либо в виде прямого воздействия свободных радикалов на миофибриллы с их повреждением, либо не прямым путем через активацию протеаз, с последующей деградацией белков миофибрилл.
Другой механизм нарушений сократительной функции кардиомиоцитов при оглушенном миокарде - накопление избыточного количества цитозольного Са - увеличение внутриклеточной концентрации ионизированного кальция (Са ++).
После восстановления кровотока, происходит избыточное, не регулируемое кальциевыми каналами поступление Са через поврежденную сарколемму. Дефицит макрофосфатной энергии не обеспечивает работу кальциевого насоса саркоплазматического ретикулума (СПР), который регулирует цитоплазматическую концентрацию Са. Недостаток АТФ в миофибриллах проявляется двояким образом: сохраняющиеся неразомкнувшиеся связующие мостики между актином и мозином (незавершенная диастола) уменьшают количество возможных мест взаимодействия, что в дальнейшем ограничивает взаимное перемещение миофиламентов в саркомере (сокращение).
Таким образом, избыточное количество цитозольного кальция способствует развитию незавершенной диастолы, развитию контрактуры миокарда.
Выживание клеток в течение некоторого периода ишемии возможно благодаря существованию рядя защитных механизмов, направленных прежде всего на ограничение расхода АТФ в миофибриллах. Эти механизмы реализуются через уменьшение входа Са ++ в кардиомиоцит и снижение чувствительности к нему сократительного аппарата.
В поддержании оглушенности миокарда принимают участие и микрососудистые нарушения, в большинстве случаев носящие вторичный характер, вследствие агрегции форменных элементов крови (тромбоциты, эритроциты, лейкоциты) на фоне контрактуры миокарда.
«Гибернация миокарда» - адаптационное снижение внутриклеточного энергетического метаболизма, путем угнетения сократительного состояния кардиомиоцита, в ответ на уменьшение коронарного кровотока.
Гибернация (Hybernatin) миокарда, по определению профессора S.Н. Rahimatoola (1999 г.) - быстро возникшее нарушение локальной сократимости левого желудочка в ответ на умеренное снижение коронарного кровотока. Для гибернирующего миокарда характерно хроническое снижение сократительной способности кардиомиоцитов при сохраненной их жизнеспособности. С точки зрения патофизиологических процессов адаптации к стрессорным ситуациям, «гибернирующий миокард» - «механизм саморегуляции, адаптирующий функциональную активность миокарда к условиям ишемии», т.е. своеобразная защитная реакция «страдающего сердца» на неадекватное уменьшение коронарного кровотока к уровню ПМО 2 . Этот термин, «гибернирующий (уснувший) миокард» S.H. Rahimatoola впервые предложил в 1984 году на Рабочей встрече по проблемам лечения ИБС в Национальном институте сердца, легких и крови США.
Авторы, используя сцинтиграфическую технику с таллием, выявили от 31 до 49% жизнеспособной ткани в участках с необратимо сниженной сократительной функцией миокарда левого желудочка. То есть в местах сниженного локального кровотока сохраняется относительно нормальная метаболическая активность - миокард жизнеспособен, но он не может обеспечить нормальную региональную фракцию выброса. При этом имеются клинические симптомы проявления ишемии, но которые не заканчиваются развитием некроза миоцитов. В клинике подобные ситуации могут иметь место при стабильной и нестабильной стенокардии, у пациентов с ХСН.
По данным Е.В. Carlson с сотрудниками, опубликованныхв 1989году, у пациентов перенесших эффективную коронароангиопластику, участки гибернации миокарда выявляются в 75% случаев среди больных с нестабильной стенокардией и в 28% наблюдений при стабильной стенокардии. Минимизация обменных и энергетических процессов в мышце сердца при сохранении жизнеспособности миоцитов позволила некоторым исследователям назвать эту ситуацию либо - «находчивым сердцем» (Smart Heart), либо - «самосохраняющееся сердце» (Self-preservation Heart) или «играющее сердце» (Playing Heart). Итальянские исследователи подобное состояние сердечной мышцы определили как «миокардиальная летаргия».
Механизмы гибернации мало изучены. В клинической практике, на фоне редуцированного коронарного резерва, постепенное развитие деструктивных изменений в гибернирующем миокарде является следствием кумулятивных сдвигов энергообмена в ответ на периодические инотропные стимуляции.
В условиях ограниченного кровотока, положительный инотропный ответ достигается за счет истощения метаболического статуса кардиомиоцита. Таким образом, постепенно накапливающиеся метаболические изменения могут стать причиной дезорганизации внутриклеточных структур сердечной мышцы.
Прекондиционирование
(Preconditioning) - метаболическая адаптация к ишемии, после повторяющихся кратковременных эпизодов снижения коронарного кровотока, проявляющаяся повышенной устойчивостью мышцы сердца к последующей, более длительной ишемической атаке.
Прекондиционирование - это благоприятные изменения миокарда, вызываемые быстрыми адаптивными процессами во время кратковременного эпизода ишемической атаки на миокард с последующим быстрым восстановления кровотока (реперфузия), которые защищают миокард от ишемических изменений до следующего эпизода ишемия/реперфузия. Этот феномен, филогенетически обусловлен, и типичен для всех органов организма млекопитающихся.
В 1986 году в экспериментальных условиях на собаках СЕ. Murry с сотрудниками убедительно продемонстрировали, что повторные короткие эпизоды региональной ишемии миокарда адаптируют сердечную мышцу к следующим эпизодам ишемических атак, что документировано сохранностью внутриклеточного АТФ на достаточном уровне для функционирования кардиомиоцита, с отсутствием некротического повреждения клеток.
В других экспериментах было показано, что предварительные прерывистые 5-ти минутных эпизода окклюзии коронарной артерии с последующими 5-ти минутными интервалами реперфузии (ишемия/реперфузия) приводят к уменьшению размеров ишемического некроза сердечной мышца на 75% (по сравнению с контрольной группой собак, которым не проводился своеобразный 5-ти минутный тренинг - ишемия/ реперфузия) в ответ на остановку кровообращения в течение 40 минут.
Подобный капрдиопротективный эффект кратковременных эпизодов ишемия/реперфузия был определен как «ишемическое прекондиционирование», При этом было отмечено отсутствие развития феномена «реперфузионного синдрома». Позднее этот защитный феномен был идентифицирован R.A. Kloner и D. Yellon (1994 г) в клинической практике.
Ранее считалось, что кардиопротективный эффект ишемического прекондиционирования проявляется непосредственно после кратковременных эпизодов ишемия/реперфузия, а затем теряет свои защитные свойства через 1-2 часа. В 1994 году D. Yellon в соавторстве с G.F. Baxter показали, что феномен «постишемического прекондиционирования» может вновь развиться через 12-24 часа с длительностью до 72 часов, но в ослабленной форме. Подобная, отдаленная фаза толерантности к ишемическому повреждению миокарда была определена авторами как «второе окно защиты» («S econd W indow O f P rotection - SWOP »), в отличие от раннего «классического ишемического прекондиционирования».
Клинические ситуации «классического ишемического прекондиционирования» - синдром «разминки» (Warm-up Phenomen) или «перехаживания» (Walk-Through-Angina), которые проявляются в постепенном уменьшении частоты и интенсивности ангинозных приступов в течение продолжающейся умеренной физической или бытовой нагрузки.
В основе феномена «расхаживания» лежит быстрая адаптация миокарда к нагрузке на фоне снижения отношения - Qкор/ПМО 2 после второго эпизода ишемии. Г.И. Сидоренко отмечает, что данный синдром наблюдается почти у 10% больных стенокардией, причем сегмент ST на стандартной ЭКГ, приподнятый во время первого приступа, снижается до изолинии, несмотря на продолжающуюся нагрузку. (Рис.7).
Аналогичная картина отмечается в ряде случаев при проведении нагрузочного тестирования, когда на высоте нагрузки появляется сте-нокардитическая боль и/или смещение сегмента ST, а при ее продолжении они исчезают. Подобные ситуации позволили сформулировать такие понятия как «первично спрятанная ангина» (First Holeangina) или «стенокардия первой нагрузки» (First - Effort-Angina).
Рис. 7. Эффект «Прекондиционирования» - исходная ЭКГ (а), спазм коронарной артерии на фоне умеренной нагрузки с подъемом ST на ЭКГ (б) и восстановление ЭКГ (в) на фоне продолжающейся умеренной нагрузки
Возможно, что ишемическое прекондиционирование лежит в основе того, что у пациентов с прединфарктной стенокардией отмечается тенденция к более благоприятному прогнозу по сравнению с теми больными, у которых ИМ развился на фоне предшествующего полного благополучия.
Показано, что предшествующие развитию инфаркта миокарда приступы стенокардии (прединфарктная стенокардия) могут оказывать защитное действие на миокард (уменьшение зоны поражения), если они возникали в течение 24-48 часов до развития ИМ. Подобные наблюдения в клиническое практике напоминают кардиопротективный эффект отдаленного ишемического прекондиционирования («второе окно защиты») в экспериментах на животных.
Феномен «отсутствие восстановления кровотока в интрамуральных к субэндокардиальных коронарных артериях»
(no-reflow) - значительное снижение коронарного кровотока у больных ИБС на фоне поражения сосудов и реперфузии, не смотря на полное восстановление проходимости (реканализация) в эпикардиальных коронарных артериях.
Имеются сведения, что в клинической практике, предынфарктная стенокардия способна уменьшить феномен «no-reflow», защищая тем самым миокард от ишемии и реперфузии, вызванными микрососудистыми повреждениями в сердце. При этом уменьшается риск развития инфаркта миокарда или его размеров, улучшается восстановление насосной функции левого желудочка в случаях его повреждения, а также значительно снижается риск внутригоспитальной летальности.
Кардиопротективная роль прединфарктной стенокардии может объясняться рядом механизмов:
1 - защита позднего постишемического прекондиционирования;
2 - раскрытие коллатерального кровообращения;
3 - повышение чувствительности к тромболизису.
Влияние ишемического прекондиционирования на размеры ИМ и на степень сохранения его функционального состояния (насосной функции сердца) после перенесенного инфаркта миокарда зависит от многих факторов, в том числе от выраженности коллатерального коронарного кровотока, от продолжительности временного интервала между началом ишемии и лечения.
При проведении реваскуляризации миокарда с помощью аорто-коронарного шунтирования с использованием активации постишемического прекондиционирования (два цикла 3-х минутной тотальной ишемии сердца с помощью временного пережатия восходящего отдела аорты в условиях искусственного кровообращения, с последующими 2-х минутными периодами реперфузии, за 10 минут до глобальной ишемии миокарда) было отмечено уменьшение выраженности некротических повреждений миокарда.
В другом исследовании при активации постишемического прекондиционирования (пережате аорты на 1 минуту с последующей реперфузией в течение 5 минут перед остановкой сердца) приводило после АКШ к значительному повышению сердечного выброса (СИ) и уменьшению потребности в введении больным инотропных препаратов.
Формирование постишемического прекондиционирования обусловлено включением множества сложных механизмов адаптации, из которых в настоящее время более изучены два: А - снижение накопления кардиомиоцитами продуктов распада гликогена и адениновых нуклеотидов, таких как ионы Н+, NH3, лактат, неорганические фосфаты, аденозин; Б - повышение активности или синтеза ферментных систем, оказывающих кардиопротективныи эффект от ишемического повреждения.
В таблице 1 представлены наиболее изученные эндогенные и экзогенные медиаторы и механизмы реализации действия ишемического прекондиционирования. В 2002 году Y.R Wang с коллегами представили убедительные данные свидетельствующие о кардиопртективном действие в фазе позднего прекондиционирования повышение продукции N0 посредством стимулирования выработки ее синтазы (I
nducible S
yntase NO
- iNOS
).
Известно, индуцированная изоформа NO синтазы содержится во многих клетках организма, в частности, в кардиомиоцитах, гладкомышечных клетках сосудов, макрофагах. Они мгновенно активируются под влиянием ряда провоспалительных факторов таких как цитокины IL-1B, IL-2, IFN-г, TNF-б и другие. В качестве эндогенных медиаторов запускающих активацию и синтез iNOS могут принимать участие аденозин, ацетилхолин, брадикинин, липополисахариды, опиоды, свободные радикалы, серотонин.
Восстановление коронарного кровотока (реперфузия) сопровождается «вымыванием» из ишемиизированной области миокарда продуктов анаэробного энергетического обмена, сдерживающих сократительную активность кардиомиоцитов, а «нахлынувшее» поступление кислорода вызывает внутри клетки своеобразный «взрыв» образования активных форм кислорода - вторичных свободных радикалов (гидроксильного - НО ‑ , липоксильного - LO ‑).
Реперфузионное снятие ингибирования активации сокращения путем «вымывания» аденозина, К + , Н + сопровождается быстрым восстановлением сократительной функции миокарда, с использованием имеющихся запасов КрФ и АТФ. Степень дальнейшего восстановления зависит от состояния митохондрий, обеспечивающих синтез фосфатных макроэргов путем окислительного фосфорилирования. Возобновление аэробного ресинтеза АТФ и его темп определяются степенью сохранности электронно-транспортной цепи и ферментов цикла
Таблица 1. Эндогенные медиаторы механизмов ишемического прекондиционирования
|
Эндогенные медиаторы прекондиционирования |
|
|
Медиаторы |
Механизмы действия |
|
Аденозин |
Через аденозин А и киназу тирозина |
|
Ацетилхолин |
Активация протеиновой киназы |
|
Опиоиды (Морфий) |
Активация S-опиоидного рецептора |
|
Норадреналин |
Активация - a - адренергический рецептор |
|
Серотонин |
Вазодилатирующий эффект? |
|
Активация К-АТФ-чувствительных каналов |
|
|
Цитокины IL-1B, IL-2 | |
|
Путем экспрессии стимуляции iNOS |
|
|
Антиоксиданты - влияние на реактивные виды О 2 |
Путем экспрессии стимуляции iNOS |
|
Внешние стимулы |
|
|
Липополисахариды (бактериальный эндотоксин) |
Способствует продукции Heat Shok Protein 70i (hsp 70i) влияющий на миокард. |
|
Монофосфолипид (MLA) |
Индукция гена iNOS |
|
Повышение экспрессии C-jun c-tos mRNA каталаз и mn - содержащей дисмутазы |
|
|
Активаторы К+-каналов: димакаин, кромакалин, никорандил |
Являются прямыми «открывателями АТФ-чувствительных К + -каналов |
Кребса в митохондриях. При наличии повреждений митохондрий, а следовательно и части цепи окислительного фосфорилирования, скорость синтеза АТФ может отставать от потребностей сократительного аппарата и восстановление сократительной функции будет неполноценным.
Задача - первоночальное восстановление энергозапасов миокарда - была предметом изучения на протяжении двух последних десятилетий, которые показали, что не АТФ, а КрФ является основным энергетическим субстратом определяющим уровень сократительной функции, потребление и восстановление которого имеют место в первую очередь после реперфузии.
Например, в «гибернирующем миокарде» (на фоне сниженного функционального состояния) уровень АТФ снижен умеренно. В отличие от АТФ уровень КрФ может быть восстановлен гораздо быстрее, потому что необходимый для его синтеза креатин покидает клетку медленнее, чем аденозин, составляющий основу АТФ. Однако, восстановление сократительной функции кардиомиоцита в результате быстрого увеличения внутриклеточной концентрации КрФ лимитируется молекулами АТФ, участвующих в регуляции ионного транспорта кардиомиоцитов.
В настоящее время, на основании данных различноуровневых исследований сформулирована гипотеза о механизмах защитного действия классического ишемического преондиционирования, суть которой связывают с модификациями внутриклеточного обмена - сохранение достаточно высокого уровня АТФ за счет ограничения утилизации макроэргических фосфатов.
Запуск ишемического прекондиционирования осуществляется взаимодействием эндогенных факторов (триггеры) с их специфическими рецепторами.
Триггеры - биологические активные вещества, выделяющиеся из кардиомиоцитов при ишемических эпизодах и реперфузии (аденозин, брадикинин, простаноиды, катехоламины, эндорфины, NО, АФК и др.), реализуют свои эффекты разными путями внутриклеточной сигнализации (Рис. 8, 9).

Рис. 8. Энергообмен при коротком приступе ишемии (А) и пути внутриклеточной сигнализации, активируемые аденозином, при ишемическом прекондиционировании (Б): ФлС - фосфолипаза, ДАГ - диацилглицерин, Ф - фосфат, ПкС - протепинкиназа, ИФЗ - инозитол трифосфат

Рис. 9. Пути внутриклеточной сигнализации, активируемые брадикинином, при ишемическом прекондиционировании: NO - закись азота, ФДЭ - фосфодиэстераза, ГТФ - гуанезинтрифосфат, цГМФ - циклический гуанезинмонофосфат, цАМФ - циклический аденозинмонофосфат
Гипотеза участия триггерной системы в запуске ишемического прекондиционирования обоснована на следующих фактах, выявленных в экспериментах:
- Внутриклеточная концентрация триггеров возрастает при ишемии;
- Его введение в коронарное русло или неишемизированный миокард вызывает защитное действие схожее с ишемическим прекондиционированием;
- Введение ингибиторов триггера блокирует кардиопротективное действие ишемического прекондиционирования.
Исходя из сущности действия факторов - естественных ограничителей сократительной функции миокарда при остановленном коронарном кровотоке, можно предположить, что сохранение их влияния после реперфузии должно сопровождаться более полным восстановлением насосной деятельности сердца.
Изложенное выше показывает, что для уменьшения повреждения миокарда при постишемической реперфузии необходимо обеспечить восстановление энергетических запасов до первоночального уровня и предотвратить избыточное образование АФК.
Различные модификации реперфузионных растоворов с антогонистами кальция (препараты Магния), повышенной концентрацией калия, с добавлением метаболитов, способствующих ускоренному синтезу адениннуклеотидов, способны улучшить восстановление насосной функции сердца после ишемии.
Для решения другой задачи - уменьшить избыточное образование АФК - возможно использование реперфузионных растворов с антигипоксантами и антиоксидантами (Актовегин).
Наконец, третий подход состоит в мобилизации собственных защитных механизмов, активизирующихся при ишемических эпизодах (основа эффекта «прекондиционирования), когда серия периодов кратковременной ишемии (болевой синдром не более 5 минут) сочетается с периодами восстановления кровотока - купирование болевого синдрома органическими нитратами сублингвально.
В недавно проведенных исследованиях обнаружено существование «второго окна защиты» или позднего ишемического прекондиционирования.
В отличие от классического ишемического прекондиционирования, защитные эффекты которого проявляются сразу же после краковременных эпизодов ишемия/реперфузия, позднее ишемическое прекондиционирование обнаруживается через сутки и более с пролонгированным и менее интенсивным ответом. Механизмы этой формы ишемического прекондиционирования обусловлены включением экспрессии генов синтеза «heat shock» белков и клеточной iNO-синтазы.
Имеются мнения, что защитное действие «второго окна» прекондиционирования опосредуется именно через увеличение образования первичных АФК, в частности - NО, во время длительной ишемии, которое блокируется скевенджерами кислородных радикалов макрофагов (рецепторы-чистильщики) и ингибиторами iNO-синтазы.
В механизмы развития защитного эффекта ишемического прекондиционирования вовлечено множество различных факторов, но, согласно последним сведениям, ведущую роль играют митохондриальные Са ++ - активируемые К + - каналы реализуемые через их влияние на изменения электронно-транспортные цепи митохондрий. Имеются многочисленные доказательства, что фармакологическое открытие АФТ-зависимых К + -каналов полностью воспроизводят защитный эффект ишемического прекондиционирования.
Митохондриальные АТФ-зависимые К + -каналы более чувстительны, чем аналогичные каналы сарколеммы, к открывающим и закрывающим сигналам
Полагают, что энергосберегающий эффект ишемического прекондиционирования обусловлен снижением активности протонной митохондриальной F0 F1 АТФазы, дефосфорилирующей основное количество АТФ при ишемии. Активность этого фермента ингибируется белком IF1, который синтезируется в ответ на ишемию с увеличением его сродства к АТФазе при ацидозе. Другими причинами могут быть снижение активности ферментов, катализирующих АТФ-зависимые метаболические реакции, меньшее использолвание АТФ миофибриллярной АТФазой в результате «Stunning», снижение активности сарколеммальной Na + , К + - АТФазы, Са ++ - АТФазы саркоплазматического ретикулума.
Следствием меньшей утилизации и деградации макроэргических фосфатов (КрФ, АТФ) при длительной ишемии является снижение внутриклеточного ацидоза, так как основным источником Н + является распад АТФ. При ишемическом прекондиционировании регистрируется меньшее накопление недоокисленных продуктов гликолиза (пируватов, фосфоглицератов, лактатов и др.), что способствует сохранению осмолярности плазмы на допустимом уровне и предупреждает внутриклеточный отек кардиомиоцитов.
Показано, что в течение короткого времени классического прекондиционирования не происходит активации генов, ответственных за ресинтез внутриклеточных белков кардиомиоцитов. В то же время образование «Heat shock» белков, iNO-синтазы, супероксиддисмутазы и некоторых ключевых ферментов энергетического обмена служат неотъемлемыми условиями проявления кардиопротекторных эффектов «второго окна».
Предполагают, что, помимо образования белков, механизмы действия «второго окна» прекондиционирования включают также генерацию свободных радикалов кислорода и пероксинитрита - продукта взаимодействия NО и О 2 - (ОNОО -). Это подтверждается тем, что предварительное введение скевенджеров свободных радикалов перед эпизодами короткой ишемии блокируют защитные эффекты отсроченного прекондиционирования.
Новой стратегией в фармакологической защите сердца от ишемических и реперфузионных повреждений является использование ингибиторов Na + /H + - переносчика в сарколемме. В нормальных условиях сарколеммальный Na + /H + - обменник не активирован. При ишемии в ответ на быстро развивающийся внутриклеточный ацидоз и, возможно, на другие стимулирующие факторы его активность повышается.
Это приводит к возрастанию внутриклеточной концентрации ионов Na + , которому также способствует ингибирование Na + /K + - АТФазы - основного механизма выведения Na ++ из миоцита. В свою очередь с накоплением ионов Na + увеличивается вход ионов Са ++ внутрь клетки через Na + /Ca ++ - обменник, что способствует «Са ++ - перегрузке». (Рис. 5).
Ингибиторы Na + /H + - обмена оказывают свое кардиозащитное действие при ишемии, частично блокируя эту последовательность ионного обмена при ишемии. Ишемическое прекондиционирование способно блокировать Na + /H + -обменник на длительный период ишемии, уменьшая перегрузку ишемизированных кардиомиоцитов ионами Na + и Са ++ на стадии ранней реперфузии. К настоящему времени синтезировано несколько групп ингибиторов, обладающих исключительно высоким сродством к Na + /H + - транспортеру и низким - к Na + /Ca ++ - обменнику и Na + /HCО 3 ? - симпортеру.
Методами ядерно-магнитного резонанса и флюоресцентных красителей было показано, что блокирование Na + /H + - переносчика сопровождается снижением частоты реперфузионных аритмий и поддержкой ионного гемостаза в ишемизированном миокарде. Одновременно зарегестрировано уменьшение образования и выхода в интерстиций неорганических фосфатов - продуктов деградации АТФ, лучшее сохранение внутриклеточного фонда макроэргических фосфатов, меньшее накопление Са ++ в матриксе митохондрий и снижение повреждений ультраструктуры кардиомиоцитов.
В настоящее время ингибирование Na + /H + - переносчика стало методом защиты сердца, который все чаще применяется в клинике, к ним относятся 4-изопропил-3-метилсульфонил-бензоилгуанидин-метансульфоната (Крипорида, НОЕ 642).
В клинической практике защитное действие ишемического прекондиционирования документируется нефармакологическим уменьшением подъема сегмента ST на ЭКГ при продолжающей тестовой нагрузке.
Таким образом, ишемия миокарда - не соответствие доставки кислорода крови з миокард потребностям аэробного синтеза аденозинтрифосфата в митохондриях для обеспечения нормальной функции сердца при данной частоте сердечных сокращений, преднагрузке, постнагрузке и сократительном состоянии сердечной мышцы. При дефиците кислорода активизируется анаэробный путь синтеза АТФ через расщепление запасов гликогена с накоплением лактата, снижением внутриклеточного уровня рН и перегрузкой кардиомиоцитов ионами кальция, манифистируемое диастоло - систолической дисфункцией.
Периоды ишемических эпизодов сопровождаются последовательно этапами метаболической адаптации - реализация различных путей внутриклеточного метаболизма («ишемическое прекондиционирование»), функциональной адаптации - снижение сократительной функции миокарда соответственно уровню энергофосфатов («гибернация миокарда») с последующей биологической реабилитацией - восстановление сократительной функции («оглушенность миокарда») или гибелью миокардиальных клеток (апоптоз) (Рис. 10).

Рис. 10.
Инфаркт миокарда. А.М. Шилов
(далее ИБС) – это целая группа сердечно-сосудистых болезней, в основу которых положено нарушение кровообращения в тех артериях, которые обеспечивают кровью сердечную мышцу под названием миокард. Данные артерии называются коронарными, поэтому ишемическую болезнь называют также коронарным заболеванием сердца.
Свое название это заболевание получило по обуславливающему его процессу, который имеет название «ишемия» и представляет собой малокровие (или недостаточное поступление крови к органу, спровоцированное сужением или, напротив, полным закрытием просвета непосредственно в артерии). Следует отметить, что преходящая ишемия может развиться и у вполне здорового человека вследствие физиологической регуляции кровоснабжения. Такое случается, например, в ходе рефлекторного спазма артерии, который обусловлен воздействием боли, холода, различных гормональных изменений, а также в результате выброса в кровь адреналина во время стресса.
Согласно статистике, в развитых странах ИБС вместе с инсультом головного мозга составляют порядка 90% всех случаев сердечно-сосудистых заболеваний.
Этиология и патогенез
Основополагающими этиологическими факторами ишемической болезни по праву считаются:- Атеросклероз коронарных артерий (в основном их проксимальных отделов). Чаще всего болезнь поражает переднюю межжелудочковую ветвь левой коронарной артерии (КА), несколько реже – правую коронарную артерию и огибающую ветку левой КА. Самой опасной локализацией атеросклероза является главный ствол именно левой КА.
- Спазм КА, развивающийся на фоне атеросклероза, который извращает реактивность артерий, тем самым повышая их чувствительность к влиянию внешних факторов.
- Тромбоз венечных артерий, развивающийся при наличии атеросклеротического повреждения.
- Аномалии венечных артерий.
Ведущий патофизиологический механизм болезни – это, прежде всего, несоответствие между потребностью самого миокарда в кислороде и теми возможностями, которыми располагает коронарный кровоток.
Главными причинами подобного несоответствия являются:
- Уменьшение коронарного кровотока из-за поражения коронарных артерий.
- Значительное усиление работы сердца вследствие роста его метаболических потребностей.
- Симбиоз сосудистого и метаболического факторов. Так, в нормальных условиях имеется достаточный резерв в увеличении либо расширении КА, который и обеспечивает возможность пятикратного увеличения именно коронарного кровотока, а, следовательно, и поставки кислорода к миокарду.
Причины
ИБС преимущественно возникает вследствие атеросклероза коронарных сосудов, сопровождаемого стенокардией, обусловленной закупориванием либо частичным перекрытием сосудов бляшками. В свою очередь, инфаркт миокарда (один из видов ИБС) является последствием разрушения бляшек и формирования из них тромбов.Но ишемия может быть вызвана и многими другими факторами, среди которых наиболее распространенными являются следующие:
- Курение. Дело в том, что угарный газ, который присутствует в табачном дыме, сильно повреждает внутреннюю оболочку всех кровеносных сосудов, тем самым увеличивая риск развития атеросклероза. К тому же никотин сужает кровеносные сосуды: так, у женщин, которые выкуривают за день пачку сигарет, риск развития ИБС увеличивается в 6 раз по сравнению с некурящими людьми. У мужчин этот показатель возрастает в 3 раза. При этом не важно, курит человек сигареты, сигары, трубку либо жует табак.
- Бесконтрольная гипертония. При повышенных показателях кровяного давления просвет артерий сужается по причине снижения степени их эластичности.
- Повышенный уровень холестерина. Влечет за собой развитие атеросклероза. Обычно в организме накапливается большое количество липопротеида, имеющего низкую плотность (ЛНП), тогда как уровень липопротеида хорошего холестерина с высокой плотностью (ЛВП) снижается. Особенную роль в этом процессе играет нарушение метаболизма липидов, а вот роль остальных нарушений наименее значима, хотя их тоже необходимо идентифицировать у лиц с ранним диагностированным коронарным атеросклерозом.
- Ожирение. Избыточная масса тела провоцирует нарушение обмена веществ, что негативно влияет не только на работу сердца, но и на функционирование многих других органов.
- Сахарный диабет. Оба вида сахарного диабета тесно связаны с развитием ишемической болезни.
- Недостаток движения. Люди, ведущие сидячий образ жизни, больше подвержены развитию ИБС.
- Психоэмоциональное напряжение. Психические перегрузки, эмоциональное переутомление, а также стрессы вызывают сужение коронарных сосудов. Интересен тот факт, что у людей с характером типа А, которым присущи такие качества как нетерпеливость и агрессия, жажда соперничества и эмоциональность, чаще диагностируются сердечно-сосудистые заболевания, включая ИБС.
- Возраст. С возрастом стенки артерий теряют свою эластичность, вследствие чего увеличивается риск их повреждения.
- Пол. Доказано, что мужчины чаще женщин болеют ИБС.
- Наследственность. Коронарное заболевание сердца передается по наследству.
Виды
Ишемическая болезнь имеет множество клинических проявлений, которые в первую очередь зависят от механизмов ее образования. К тому же представления кардиологов относительно механизмов развития данного заболевания постоянно меняются, поскольку расширяются научные знания про этиологию этой болезни. Надо сказать, что построение классификации ИБС значительно осложняется тем, что различные формы ишемии сочетаются друг с другом, достаточно быстро и почти непредсказуемо переходят одна в другую. Но все же определенная классификация ИБС существует.Выделяют две формы течения заболевания:
- Острую . Проявляется эта форма острым инфарктом миокарда и внезапной коронарной (или сердечной) смертью.
- Хроническую . Проявляется стенокардией, разными типами аритмий, сердечной недостаточностью. Перечисленные формы встречаются как по отдельности, так и одновременно.
Инфаркт миокарда
Это грозная болезнь, которая в ряде случаев переходит в длительный приступ стенокардии. Данная форма ИБС обусловлена, прежде всего, острейшей недостаточностью кровоснабжения самого миокарда, вследствие чего в нем образуется очаг некроза. Главной причиной развития инфаркта миокарда является полное или практически полное закупоривание артерий тромбом либо набухшей атеросклеротической бляшкой. В процессе полной закупорки артерии образуется крупноочаговый инфаркт миокарда.
Такое название обусловлено тем, что при данном виде инфаркта непосредственно в сердечной мышце формируется один, но достаточно крупный очаг некроза. В том случае, если закупоривание артерии частичное, в миокарде образуется несколько мелких очагов некроза (тогда речь идет про мелкоочаговый ИМ). Следует помнить о том, что такая тяжелая форма ИБС, как и острый ИМ, нельзя лечить домашними средствами. По этой причине при затянувшемся приступе стенокардии, который не купируется при помощи нитроглицерина, необходимо немедленно вызывать бригаду скорой помощи.
Внезапная сердечная смерть
Это самый тяжелый вид ИБС, который протекает молниеносно и характеризуется внезапной остановкой сердца больного. К данному виду ИБС относят лишь те случаи внезапной остановки сердечной деятельности, при которых смерть наступает на протяжении часа после появления первых угрожающих симптомов, причем перед смертью состояние больного оценивалось, во-первых, как стабильное, во-вторых, как не вызывающее опасений. При постановке диагноза «внезапная коронарная смерть» в обязательном порядке исключаются все иные причины (например, травмы).Крайне высок риск внезапной коронарной смерти у больных с нижеперечисленными заболеваниями и нарушениями:
- острым ИМ,
- застойной сердечной недостаточностью,
- различными желудочковыми аритмиями,
- повышенным давлением,
- нарушенным углеводным и жировым обменами.
Так, перед наступлением внезапной коронарной смерти примерно у 50% больных отмечается сильнейший болевой приступ, который зачастую сопровождается страхом близкой смерти. Часто внезапная сердечная смерть наступает во внебольничных условиях, чем и определяется высокая смертность от данной формы ИБС. При первых признаках внезапной сердечной смерти следует незамедлительно провести сердечно-легочную реанимацию, включающую восстановление проходимости дыхательных путей. Кроме того, в таких случаях необходимы такие реанимационные мероприятия как искусственная вентиляция легких, медикаментозная терапия и непрямой массаж сердца.
Безболевая ишемия
Это опасный вид ИБС, характеризующийся отсутствием болевого синдрома, вследствие чего фиксируется около 70% случаев внезапной коронарной смерти. К тому же этот вид ишемии существенно увеличивает риск образования аритмий, а также застойной сердечной недостаточности. Определить безболевую ишемию может лишь кардиолог при помощи специальных методов исследования, среди которых продолжительное холтеровское мониторирование экг, функциональные нагрузочные тесты, а также эхокардиография. При своевременном проведении обследования и правильном диагностировании безболевая ишемия миокарда поддается лечению.Стенокардия

Это самая распространенная форма ИБС, проявляющаяся болевыми приступами, локализованными в области грудины. Боль появляется внезапно и быстро исчезает. Продолжительность приступа может составлять несколько секунд, а может достигать 15 минут. Боль в большинстве случаев появляется вследствие физического напряжения, например, во время ходьбы (так называемая стенокардия напряжения). Несколько реже стенокардия спровоцирована умственной работой, эмоциональными перегрузками, переохлаждением. В зависимости от степени заболевания стенокардия бывает первичной, стабильной и прогрессирующей. При дальнейшем развитии ишемической болезни стенокардия напряжения может дополниться стенокардией покоя, в ходе которой боль ощущается как при напряжении, так и в состоянии покоя, а иногда даже по ночам.
Постинфарктный кардиосклероз
Это форма проявления ИБС, возникающая в качестве прямого следствия перенесенного инфаркта миокарда, представляет собой поражение сердечной мышцы (зачастую поражаются также и сердечные клапаны) по причине формирования в них рубцовой ткани, которая имеет вид участков разной величины и распространенности. Образовавшаяся рубцовая ткань со временем замещает миокард, что и приводит к развитию постинфарктного кардиосклероза. Но постинфарктное состояние – это далеко не единственная причина этого вида ИБС. Так, среди наименее распространенных причин можно отметить травмы сердца и дистрофию миокарда.Частые проявления кардиосклероза – это сердечная недостаточность, а также различные аритмии. Под сердечной недостаточностью понимают комплекс состояний, которые приводят к ослаблению сократительной способности сердечной мышцы, вследствие чего сердце не может обеспечивать организм достаточным количеством крови. Неизбежный результат сердечной недостаточности – это появление в организме всевозможных отклонений в кровообращении, причем такие отклонения могут ощущаться самим больным, а могут быть определены лишь в ходе кардиологического обследования.
Аритмия
Аритмией принято называть разные по характеру, происхождению, а также значению отклонения ЧСС. Главная причина образования аритмий – это поражение разных отделов сердца, хотя часто фиксируются случаи аритмий, спровоцированных эндокринными болезнями и нарушениями функционирования нервной системы.Выделяют четыре основные группы аритмий:
- Тахикардия – учащение ЧСС, которое бывает желудочковым и наджелудочковым. При тахикардии ЧСС превышает 90 ударов в минуту.
- Брадикардия – уменьшение ЧСС ниже 60 ударов в минуту. Чаще всего брадикардия спровоцирована возрастом или физической активностью.
- Экстрасистолия – внеочередные сокращения сердца (экстрасистолы), которые обусловлены импульсами, поступающими из образовавшегося в миокарде дополнительного очага возбуждения.
- Блокада сердца – состояние, при котором импульс не проходит через определенные зоны сердечной мышцы. Иногда блокада сердца оканчивается полной остановкой сердца.
Симптомы

Первым симптомом ИБС чаще всего является чисто субъективное тягостное ощущение, сопровождающееся болью в области сердца. Чем раньше больной обратит внимание на такую боль, тем лучше. Так, поводом для посещения кардиолога должно стать любое неприятное ощущение, связанное с сердцем, особенно если боль, тяжесть или покалывание в области сердца ранее не наблюдались.
Внимательно следует отнестись даже к вполне «знакомым» ощущениям, которые видоизменили свой характер либо условия возникновения. Заподозрить ишемическую болезнь сердца позволяет приступообразная боль в загрудинной области, возникающая во время физической либо эмоциональной нагрузки, при этом болевой синдром утихает в состоянии покоя.
В большинстве случаев ИБС протекает волнообразно: так, периоды спокойствия, не сопровождающиеся выраженными симптомами, сменяются периодами обострения болезни. Развитие ИБС может длиться десятилетиями, при этом за время развития и прогрессирования болезни могут меняться не только ее формы, но и клинические проявления. Следует отметить, что треть пациентов с ишемической болезнью могут вообще не ощущать никаких симптомов этой коварной болезни. Особенно это касается пациентов с безболевой ишемией. Остальные больные могут испытывать боль в груди, отдающую в руку, боль в нижней челюсти и в спине, одышку, тошноту, повышенное потоотделение, учащенное сердцебиение либо любые иные нарушения сердечного ритма. Таким образом, симптоматика ишемической болезни сердца – это признаки какой-либо одной из ее форм. Посему далее будут рассмотрены симптомы, присущие наиболее распространенным видам ИБС.
Симптоматика внезапной сердечной смерти
У больных за два – три дня до приступа наблюдается появление приступообразных и неприятных ощущений в загрудинной области. Кроме того, фиксируются различные психоэмоциональные расстройства, сопровождающиеся страхом близкой смерти.Симптомы самого приступа включают:
- потерю сознания,
- остановку дыхания,
- отсутствие пульса на сонных, а также бедренных артериях,
- отсутствие тонов сердца,
- резкое расширение зрачков,
- изменение оттенка кожи (так, кожный покров приобретает бледно-серый оттенок).
Симптоматика стенокардии
Основной симптом стенокардии (этот вид ИБС часто называют «грудной жабой») – это боль, локализованная в загрудинной области (чаще всего болит именно левая сторона). Боль отдает в плечо и руку, в шею и спину. Стенокардический приступ сопровождается ощущением сдавливания, тяжести или жжения за грудиной, при этом интенсивность болевого синдрома бывает различной – от легкой до крайне сильной (нестерпимой). Боль часто сопровождается тревогой и чувством страха смерти, упадком сил, повышенной потливостью и тошнотой. Больной бледнеет, у него понижается температура, заметно учащается сердцебиение, кожа становится влажной, а дыхание частым и поверхностным. Как правило, приступ стенокардии редко длится больше 10 минут и может быть купирован при помощи нитроглицерина, расширяющего сосуды и помогающего наладить нормальное кровоснабжение.Развитие стенокардии проходит в двух вариантах:
- Стабильном. Характеризуется болевым синдромом, появляющимся лишь при нагрузке, которая может физической либо нервно-психической. В состоянии покоя боль быстро проходит самостоятельно либо после приема нитроглицерина.
- Нестабильном. Загрудинная боль появляется в состоянии покоя или при малых нагрузках, у больного наблюдается одышка. Это крайне опасное состояние, приводящее к развитию ИМ. Приступ нестабильной стенокардии может длиться несколько часов.
Симптоматика инфаркта миокарда
Симптомы инфаркта миокарда на начальном этапе приступа схожи с клинической картиной стенокардии. Позже инфаркт развивается абсолютно по другой схеме, представляя собой приступ боли за грудиной, который, во-первых, не утихает на протяжении нескольких часов, во-вторых, не купируется употреблением нитроглицерина, что характерно для приступа стенокардии.Приступ ИМ сопровождается следующими проявлениями:
- значительным повышением давления,
- повышением температуры,
- удушьем,
- перебоями сердечного ритма (аритмией),
- частым поверхностным дыханием,
- слабым пульсом на конечностях,
- потерей сознания,
- ощущением слабости,
- тошнотой,
- рвотой,
- бледностью кожного покрова.
Симптоматика кардиосклероза

Основные проявления кардиосклероза – это симптомы сердечной недостаточности, а также аритмии. Самым заметным признаком сердечной недостаточности является патологическая одышка, которая возникает при минимальных физических нагрузках либо в состоянии покоя. Нельзя не сказать о таких признаках сердечной недостаточности как учащенное сердцебиение, повышенная утомляемость, а также отечность, что спровоцировано сильной задержкой жидкости непосредственно в организме.
Симптоматика аритмий различна, поскольку это общее название, используемое для абсолютно разных состояний, объединенных лишь тем, что все они тем или иным образом связаны с перебоями в работе и ритме сердечных сокращений. Объединяет разные виды аритмий один признак – это неприятные ощущения, которые связаны с тем, что больной человек чувствует, что его сердце бьется «неправильно» (слишком быстро, медленно или с перебоями).
Подводя итоги, хотелось бы отметить следующее: если ишемическая болезнь сердца своевременно выявлена и правильно диагностирована, если назначено соответствующее лечение, то больной имеет отличные шансы на полноценную и яркую жизнь в дальнейшем.
Кардиолог
Высшее образование:
Кардиолог
Кабардино-Балкарский государственный университет им. Х.М. Бербекова, медицинский факультет (КБГУ)
Уровень образования – Специалист
Дополнительное образование:
«Кардиология»
ГОУ «Институт усовершенствования врачей» Минздравсоцразвития Чувашии
Ишемическая болезнь, проявляющаяся патологическими изменениями сердечной деятельности, в современном мире приобрела характер эпидемии из-за возросшего количества заболевших, инвалидности, смертности от неё. Ишемическая болезнь сердца (ибс) возникает из-за острого или периодически повторяющегося снижения кровоснабжения - ишемии миокарда (мышечной ткани, перекачивающей кровь) и кислородного голодания сердца из-за него. Чтобы понять, как, отчего это происходит, нужно рассмотреть последовательность процессов возникновения, течения болезни в их совокупности, т. е. ибс патогенез.
Этиологические и патогенезисные характеристики
Любой патогенез позволяет анализировать весь процесс заболевания начиная с причин (этиологии), вызывающих болезнь.
Этиология и патогенез ибс фиксируют возникновение дисбаланса между необходимым для миокарда кислородом и тем, который поступает в него реально благодаря ограниченным возможностям кровотока коронарных сосудов. Несоответствие возникает также при прямом ограничении кровоснабжения или снижении уровня давления крови. Всё это обусловлено:

- нарушением кровотока (органической обструкцией) в коронарных артериях из-за их атеросклероза (отложений холестерина на внутренней сосудистой оболочке) с различной степенью сужения сосудов;
- выраженным и продолжительным спазмом сосудов сердца из-за его патологических изменений - динамическим стенозом;
- нарушением эластичности стенок сосудов, препятствующим их расширению из-за недостатка сосудорасширяющих факторов, в частности, аденозина (активного вещества, повышающего упругость тканей и имеющего антиаритмический эффект);
- повышенной потребностью сердечной мышцы в обогащении кислородом из-за резко возросших физических, психоэмоциональных нагрузок, вызывающих слишком активный выброс в кровь веществ типа адреналина, дофамина, что приводит к отравлению тканей;
- тромбозом (образованием тромба - кровяного сгустка) сосудов, микротромбированием их русла;
- неодинаковостью сужения мелких сосудов, потерей их способности к расширению (микроваскулярной дисфункцией).
Патогенетические механизмы
Чаще всего бывает одно или несколько подобных нарушений в сочетании. К примеру, чем больше вынуждено работать сердце для перекачивания крови и сильнее сужены его сосуды, тем выше кислородное голодание.
Снижение или полное прекращение кровотока у больных часто возникает при спазме сосудов. Просвет между их стенками изменяется из-за атеросклеротических отложений. Есть случаи, когда отмирание сосудистой ткани, её кальцинирование оставляет суженный просвет стенок без изменения. Тогда обострение недостаточного кровоснабжения вызывается спазмом боковых сосудов поражённого участка сердечной мышцы, участвующих в окольном кровотоке.

При приступе стенокардии, как можно скорее вызывайте скорую
Важный патогенетический фактор заболевания - функциональные нарушения образования тромбоцитов, участвующих в свёртываемости крови, повышающих её своим большим количеством. Это затрудняет микроциркуляцию капилляров сердечной мышцы, образует артериальный тромб. Стенки сосудов сужаются, становятся жёсткими, в местах сужения течение крови замедляется. Это вызывает приступы стенокардии, т. е. из-за тромбообразований ибс обостряется. Суженность просветов артерий приводит к частым, продолжительным сердечным болям, нарушениям кровотока, кислородоснабжения, потери работоспособности миокарда вплоть до отмирания клеток.
Система кроветворения здорового человека производит норму тромбоцитов не только для приостановки кровотечения, поддержания крови в разжиженном состоянии (первичный гемостаз), но и дополнительно, если первого количества их для мелких сосудов оказалось недостаточным (коагуляционный гемостаз). Всё это сохраняет сосудистую стенку целостной, останавливает кровоточивость за 1–3 мин. ещё и благодаря спазму микрососудов. Способность тромбоцитов прилипать к сосудистым стенками играет как положительную, так и отрицательную роль. В случае нарушения их функционирования это связано с быстрым ростом их количества и скоростью склеивания с образованием тромба.
Важный механизм нарушения при ИБС, в её особой форме (Х–синдром) - микроваскулярная дисфункция сосудов с малым диаметром. Из-за увеличения их объёма за счёт прибавления количества клеток (гиперплазии) происходит деформирование, различное по степени сужение разных участков. Это в итоге даёт перебои снабжения миокарда кислородом при увеличенной потребности в нём.
Кардиальный синдром
Патогенез ишемии сердца у некоторых больных (около 15%) при объективных симптомах не показывает атеросклерозного сужения крупных коронарных артерий. Такое течение болезни называют «кардиальным синдромом Х». Это поражение мелких сосудов. Есть и другие причины заболевания, относящиеся к редким. Они вызывают ишемические повреждения миокарда. К ним относят:
- Врождённые аномалии коронарных артерий, наследственные патологии их развития.
- Воспалительные поражения артериальных тканей – коронариты. Их провоцирует воспаление при системных заболеваниях, периартритах и т. п., которое захватывает уже и сосуды.
- Инфекционное воспаление стенок аорты, вызванное специфическим возбудителем - сифилитический аортит.
- Выпячивание стенки грудной аорты (аневризма).
- Спонтанное или возникшее из-за выпячивания расслаивание коронарного сосуда.
- Перекрытие артерий коронарного снабжения миокарда, происходящее из-за порока сердца ревматического характера, инфекций эндокарда (внутренней оболочки сердечной стенки), нерегулярности сокращений предсердий (фибрилляции).
- Разрастание, уплотнение соединительной ткани, вызванное лучевой терапией при опухолях (лучевой фиброз).

Нарушения функциональности миокарда
Миокардическая ишемия приводит к нарушениям сердечной функциональности, что проявляется в трудностях сокращения, возбуждения, проводимости. То есть нарушается система взаимосвязи. Клетки, подверженные поражению вследствие нарушения обмена кислородом, изменяют свой потенциал деятельности. Нарушение сократимости миокарда ослабляет функции работы левого желудочка сердца, что приводит к хронической сердечной недостаточности. При сбоях возбудимости - отклика на нервный импульс и активации с поступлением в клеточное содержимое ионов натрия, а затем кальция - могут возникнуть аритмии. Этот тип нарушения ритмов сердца проявляется учащённым пульсом из-за трепетания, быстрых нерегулярных сокращений предсердий и желудочков. Проводимость сердца от принятия импульса до распространения его в волокнах миокарда при патологии может приводить не только к одышке, ощущениям сердечных «перебоев», но и к блокаде, что часто завершается летально.
Больной испытывает боль в груди, затруднённость дыхания, головокружение и т. п. Однако при кратковременных патологических проявлениях в сердечной мышце серьёзные изменения не возникают. Когда этот приступ затягивается на полчаса и более, то дистрофия в местах поражения уже ярко выражена.
Все повреждения миокарда при ИБС могут быть необратимыми и обратимыми.
Обратимые - те, что развиваются в первые полчаса. Они могут полностью исчезнуть если исключён фактор, провоцирующий их.

Необратимые кардиомиоцитные повреждения (мышечных сердечных клеток) возникают, если приступ длится более получаса. Через сутки формируется зона отмирания тканей - инфаркт, который по расположению очагов подразделяется на виды:
- Централизованный, при нём клетки сердечной мышцы - кардиомиоциты вытянуты. Омертвение (некроз) происходит путём высыхания тканевого белка (коагуляционный вид, сухой), накопления кальция, патологии клеточного ядра.
- Некроз сократительных элементов мышечного сердечного волокна (коагуляционный с перетеканием в миоцитолиз). Он бывает на периферических частях мышц, связан как с нарушением кровотока, так и с его восстановлением.
- Отёк из-за накопления натрия и воды с разрушением энергетических баз клеток (митохондрий).
В первые часы проявления болезни вокруг отмирающих участков появляется зона воспаления с привлечением к ней эритроцитов, лейкоцитов, направленных на удаление инфекции. Затем там начинают преобладать макрофаги - клетки, переваривающие бактерии с токсинами, фибробласты - основные клетки соединительной ткани и образовавшиеся новые сосуды. Через полтора месяца участок некроза затягивается молодой соединительною тканью, формируя на нём склероз. Заболевание перерастает в хроническую форму (постинфарктный кардиосклероз и атеросклероз, приводящий к стенозу венечных сосудов).
Закономерности заболевания
Современные исследования ишемической болезни сердца выявили, что патофизиология заболевания (механизмы и закономерности возникновения патологических изменений в больном органе) в его естественном протекании обусловлена двумя факторами:
- Степенью закупоренности сосуда и количеством поражённых таким образом сосудов.
- Патологией работы левого желудочка сердца.
Коронарная недостаточность
Самой распространённой основой сердечной ишемической болезни является атеросклероз. Бляшки на стенках коронарных артерий - венечных сосудов, доставляющих с артериальной кровью в миокард кислород - находятся чаще всего в начале их русла. Сосудики-веточки (интрамуральные), отходящие от главных сосудов, образующие сеть по всей мышце сердца, становятся неактивными. Если основное кровоснабжение затруднено, то в работу включаются параллельные коллатеральные сосуды, с меньшим диаметром, чем коронарные. В здоровой сердечной мышце они не подвержены активной работе. Там, где есть нарушение, вызывающее обходной кровоток, на помощь приходят вспомогательные сосуды, увеличивающие приток крови к миокарду. Это позволяет избежать полного прекращения кровоснабжения и разрастания очагов поражения мышцы сердца.
Изменения сосудистого русла, связанные с атеросклерозом, вызывают кратковременную или хроническую коронарную непроходимость в поражённом сосуде. Когда коронарные сосуды здоровы, сердце работает автоматически, без усталости, получая в соответствии с потребностями организма все питательные вещества и кислород в свои клетки. Если артерии поражены, из-за этого заужены, миокард работает неполноценно. При длительности такого процесса возникают необратимые изменения в тканях, биохимическом составе сердечных клеток, что приводит к развитию ишемической (коронарной) болезни сердца.
Значительная роль в кровоснабжении сердца принадлежит именно левому желудочку. Это обусловлено тем, что в нём берёт начало большой круг кровообращения. Левый желудочек с овальной формой (в разрезе) и сильной мускульной системой имеет большие размеры по сравнению с правым. Несмотря на то что все отделы сердца работают синхронно, всё же на левый желудочек нагрузка проявляется сильнее. Большая скорость кровотока соответствует повышенному кровяному давлению на стенки желудочка, что интенсивнее растягивает их, приводя к утолщению. Вследствие этого теряется эластичность межкамерной перегородки, происходит деформация, которая сначала себя не обнаруживает. Постепенно процесс обостряется, это проявляется такими признаками, как:

- аритмия;
- слабость, утомляемость;
- периодическое полуобморочное и обморочное состояние;
- бледность, синева кожи, губ;
- затруднённость дыхания (одышка).
Патология работы левого желудочка сердца связана со смещением его вниз, увеличением в размерах, нарушением частоты сокращений, что обостряет течение коронарного заболевания и может привести к смерти пациента.
Классификация заболевания при патогенезе
В название заболевания - ишемическая болезнь сердца - входят:
- Первичная остановка работы органа из-за прекращения кровоснабжения (внезапная коронарная смерть).
- Стенокардия: напряжения (первичная, стабильная или прогрессирующая) и вариантная (спонтанная).
- Безболевая («немая») форма дефицита кислорода сердечной мышцы.
- Энергетическая недостаточность в повреждённых местах миокарда (очаговая дистрофия).
- Сердечная недостаточность, нарушения ритма.
- Отмирание клеточной ткани сердца (инфаркт миокарда): крупноочаговое - трансмуральное, мелкоочаговое - нетрансмуральное.
- Постинфарктный кардиосклероз (жёсткое рубцевание ткани сердца вместо эластичных мышечных волокон, приводящее к трудностям в перекачивании крови и деформированию сердечных клапанов);
- Аневризма сердца (истончение и выпячивание стенки миокарда) как осложнение ИБС.
Провоцирующие болезнь факторы
Ишемия сердца вызывается факторами риска, подразделяющимися на две группы:
1. Изменяющиеся, которые можно исключить - модифицированные:
- вредные привычки, особенно курение, алкоголизм, злоупотребление жирной, углеводистой, холестерин содержащей пищи;
- сахарный диабет;
- артериальная гипертензия – длительное повышение верхнего показателя давления (систолического) от 140 мм ртутного столба и выше, нижнего (дистолического) до 90 и более;
- излишняя масса тела, приводящая к ожирению;
- снижение нормы холестерина сердца липопротеидов высокой плотности, так называемого полезного; повышение холестерина липопротеидов низкой плотности – «вредного», показатель общего холестерина сердца ˃6,5 ммоль/л;
- низкая двигательная активность (гиподинамия);
- побочные действия долговременного приёма гормональной контрацепции;
- гипотиреоз;
- психоэмоциональное, физическое перенапряжение.
2. Неизменяемые - немодифицированные:
- Мужской возраст старше 55 и женский - от 65.
- Наследственность.
- Принадлежность к мужскому полу (мужчины болеют гораздо чаще).
Среди этих факторов значительна часть таких, которые очень влияют на возникновение ИБС. Риск развития повышается, если таких провокационных обстоятельств фиксируется несколько.

Симптомы ИБС чаще выражены у людей после пятидесяти лет
Симптоматика ИБС
Симптомы ИБС чаще выражены у людей после пятидесяти лет при повышении привычной физической нагрузки. Это, как правило:
- Загрудинная боль или в средней части грудной клетки, нижней челюсти, спине, под ребром, отдающая в руки, живот.
- Очень высокая частота сокращений мышцы сердца - более трёхсот в минуту, вызывающая остановку кровообращения.
- Ощущение нехватки воздуха.
- Тошнота, изжога, пищеварительный дискомфорт.
- Холодный пот.
Есть случаи, когда симптомы заболевания вообще не проявлялись.
Процессу характерно волнообразное течение, что влияет на проявление симптомов. Прогрессирование заболевания ведёт к переходу из одной формы в другую, более тяжёлую, имеющую в каждом отдельном случае свои особенности течения.
К ним присоединяются психические проявления, свойственные ИБС:
- Панические атаки, страх смерти.
- Возбуждение без причины, беспокойство.
- Апатия, необъяснимая тоска.
- Постоянное чувство гипоксии, удушья.
Современный патогенез ишемии дополняется новыми научными работами, технологическими исследованиями, позволяющими обновлять информацию о нём. Однако, те закономерности, которые характерны для него, очевидны, не подвергнуты сомнению и обязательно учитываются при диагностике и лечении данной болезни.
Ишемическая болезнь сердца считается первоочередной причиной инвалидности и смертей, она приводит ко многим хроническим заболеваниям. Ее появление обусловлено недостаточностью кровотока, что приводит к голоданию орган, а также не позволяет полноценно снабдить кислородом другие ткани.
Чаще всего провоцирует развитие ишемии атеросклероз коронарных артерий, когда из-за холестериновых бляшек в них сужается просвет, уменьшающий кровоток. На втором месте появления болезни стоят тромбоз, спазм, эмболия артерий, затем врожденные патологии.
Анатомия
Для постоянного снабжения организма кислородом и питательными веществами сердце должно получать достаточное количество энергии, которая позволит ему перекачивать кровь. Каждую минуту мышечный орган требует для своей работы кислорода намного больше, чем другие.
- Вся информация на сайте носит ознакомительный характер и НЕ ЯВЛЯЕТСЯ руководством к действию!
- Поставить ТОЧНЫЙ ДИАГНОЗ Вам может только ВРАЧ!
- Убедительно просим Вас НЕ ЗАНИМАТЬСЯ самолечением, а записаться к специалисту !
- Здоровья Вам и Вашим близким!
Для интенсивного режима нужна бесперебойная работа правой и левой венечных артерий, которые в силу своих функциональных особенностей способны это делать. Передняя межжелудочковая и огибающая – это ветви, на которые делится левая артерия.
Для снабжения левого и частично правого желудочков кровь поступает через переднюю межжелудочковую ветку. Разветвления сосудов, которые отходят от нее, питают межжелудочковую перегородку на 2/3.
Левое предсердие, передняя и задняя стенки левого желудочка, синусовый отдел снабжаются кровью благодаря огибающей ветви левой венечной артерии.
Другие части органа обеспечивает кровью правая артерия. В силу индивидуальных различий из-за расположения артерий кровоток миокарда может выполняться по-разному.
Поэтому кровоснабжение сердца может быть:
- равномерным;
- левовенечным;
- правовенечным.
При равномерном обе артерии одинаково выполняют свою работу, кровоснабжение стабильно и без отклонений. Такой тип кровоснабжения считается наиболее распространенным. Два других типа обусловлены доминированием одного из крупных сосудов.
Функциональное значение левой венечной артерии преобладает над правой, она чаще всего обеспечивает кровью большую часть органа. Кровоснабжение сердечной мышцы обеспечивается разветвленной сетью синусов, капилляров, сосудов, отток крови происходит по венам.
Анатомически свое начало коронарные артерии берут от устья аорты, за счет чего в них преобладает повышенное давление, способствующее притоку крови. Даже когда человек находится в спокойном состоянии сердце способно извлечь из крови до 75% кислорода, который становится для него энергией, дающей возможность работать.
При патологии немаловажная роль для коронарного обеспечения отводится образованию интеркоронарных анастомозов, количество которых превышает 10–20% от нормального протекания процессов. На их образование, количество и величину влияют не возраст человека, а наличие у него коронарного атеросклероза или порока клапанов.
Нормы
Для обеспечения коронарного кровотока, который будет отвечать потребностям сердечной мышцы, требуется хорошая пропускная способность артерий. У здорового человека уровень кровотока может повыситься в 5–6 раз при интенсивной нагрузке по сравнению со спокойным состоянием.
Когда увеличивается нагрузка на сердце, кровоток в коронарных артериях увеличивается за счет:
- давления, которое в них создается;
- благодаря расширению венечных артерий, что снижает сопротивление тока крови;
- увеличения частоты сердечных сокращений.
На развитие патологии миокарда и возникновения ИБС у любого здорового человека влияет наличие причин, которые могут ее вызвать, но также и анатомическое строение – сосудистая и артериальная извитость, высокое давление, которое в них создается.
По сравнению с другими участками сердечно-сосудистой системы возникновение атеросклероза здесь наблюдается чаще всего.
При ишемии только у небольшого процента людей венечные артерии не переживают изменения, у большинства лиц наблюдается их атеросклероз.
Основы патогенеза ИБС
Ишемия сердечной мышцы вызывает ряд событий:
- снижение давления в коронарных артериях;
- метаболизм без использования кислорода (анаэробный обмен);
- механические изменения миокарда, когда нарушается его диастолическая функция и сократимость;
- изменения на электрокардиограмме;
- болевые проявления.
Когда кровоток восстанавливается, а ишемия исчезает, в течение продолжительного времени до нескольких дней наблюдается постишемическая депрессия обменных процессов и функций сердечной мышцы.
Ишемический каскад заканчивается клиническими проявлениями именно на последующих этапах, что может привести к фибрилляции желудочков. Функциональное состояние миокарда не способно быстро восстановиться, метаболические нарушения не исчезают, даже если купировать болевой синдром.

На патогенез ИБС оказывает существенное влияние число пораженных атеросклерозом артерий и степень сужения просветов в них. Важными факторами, которые влияют на протекание болезни, являются:
| Атеросклеротические бляшки | Немаловажным является расположение бляшек в сосудах. Большинство погибающих людей имеют степень поражения магистральных артерий на 75%. Чаще всего атеросклероз поражает:
Самой опасной для здоровья считается локализация бляшек в стволе левой артерии, что приводит к тяжелой степени стенокардии и внезапным смертям. Но интенсивные нагрузки являются значимыми и при поражении мелких сосудов, отходящих от коронарных артерий. Развитие мягких атеросклеротических бляшек с тонкой покрышкой, которые не вызывают существенного сужения сосудов, приводит к их быстрому росту и разрыву в силу структурных особенностей. В образующиеся микротрещины попадает кровь, увеличивая размер бляшки. Ее содержимое выбрасывается вместе с кровотоком в артерию, что скорее приводит к тромбообразованию, стенозирует артерию, провоцируя стенокардию, инфаркт, внезапную смерть. Но события могут развернуться и по-другому. Покрытие бляшки уплотняется, ее объем уменьшается, что увеличивает кровоток. Вероятность возникновения патологии при этом уменьшается. ИБС можно характеризовать, как монотонный процесс, при котором фазы обострения сменяются стабилизацией. |
| Спазмы сосудов |
|
| Тромбы |
|
Три основных фактора в зависимости от индивидуальных особенностей человека и стадии протекания заболевания могут вызвать прогресс ИБС, а могут привести к терпимой хронической патологии. Но процесс формирования бляшки является основным и наиболее важным.
Клинические формы
Диагноз ИБС устанавливается с помощью ее клинической формы, принятой согласно классификации ВОЗ. У большинства пациентов болезнь возникает внезапно, без предшествующей клиники, у меньшего количества людей развитие происходит постепенно, когда признаки нарастают со временем.
Клинические проявления предполагают наличие у пациента:
| Внезапная коронарная смерть |
|
| Стенокардия |
|
| Инфаркт миокарда |
|
|
|
| Нарушения сердечного ритма | Аритмия может протекать на фоне различных заболеваний, иногда не связанных с функциями сердца, но чаще всего она сопровождает атеросклеротическую патологию. |
|