Большая энциклопедия нефти и газа. Термическое разложение древесины
Лекция №18. Термическое разложение
План лекции
1. Принцип термического разложения веществ.
2. Разложение цирконового песка.
3. Десиликация каолина.
Процесс диссоциации с учетом высоких достигаемых температур может иметь большое значение и для очень устойчивых в иных условиях окислов, напряжение диссоциации которых показано на рис. 54. Известно, что диссоциация окислов наступает тогда, когда напряжение диссоциации превышает «парциальное давление кислорода в окружающей атмосфере.
При использовании газа, содержащего очень малые количества кислорода, парциальное давление кислорода, например в случае аргона, может достигать порядка нескольких Паскалей; возможны диссоциация и разложение таких прочных связей, как у АlO 3 , SiO 2 и MgO Были опубликованы также работы о получении молибдена из MoS 2 .
При оригинальной технологии разложения «Хинарк» (Шира - Кормана) в случае переработки огнеупорного сырья руду смешивали лишь с таким количествам углерода, чтобы обеспечить электрическую проводимость формованного обожженного электрода. В ходе дальнейших работ пришли к выводу, что анод можно получить из смеси руды и углерода, свободно уложенных в графитовой обойме. Благодаря этому уда - лось сэкономить средства на изготовление стержневых электродов. Для обоих указанных видов анодов плазменное пламя состояло преимущественно из паров отдельных элементов, включая определенную долю паров углерода, которая достигала примерно 15 - 20%. Продукты сгорания, которые свободно конденсировались на воздухе, состояли из смеси окислов, причем газообразная окись углерода попадала в атмосферу. Хотя исходное сырье содержало комплексные соединения, например эвксенит или огнеупорные силикаты, было установлено, что обратные реакции при охлаждении приводят к образованию только простых окислов (т. е. моноокислов) или даже субокислов. Общая длительность пребывания свободных атомов и ионов в плазменном пламени, имеющем высокую скорость, слишком мала для того, чтобы происходили столкновения многих атомов. Так, например, при использовании в качестве исходного материала родонита образуется мелкодисперсный МnО и SiO 2 , а при использовании бериллия BeO, Al 2 O 3 и SiO 2 .
Рисунок 54. Зависимость давления диссоциации оксидов от температуры
С помощью масс - спектроскопии можно различить заряженные частицы различной массы. Уже были опробованы способы взаимоотделения окислов в электростатических или магнитных полях либо путем фракционированной конденсации. Однако успешные результаты были достигнуты только в случае сепарации, основанной на использовании точки росы, при которой фильтрующий коллектор, принимающий конденсированные твердые частицы, помешали в такое место потока продуктов сгорания, где температура была выше точки росы нежелательных элементов или соединений. Однако на практике тока более целесообразно собрать большинство окислов в виде смеси и обрабатывать их затем каким - либо другим способом. В принципе такой двухступенчатый процесс аналогичен обычному процессу переработки руд, когда руды сначала расплавляют, затем охлаждают и, наконец, из них извлекают металл. Единственная существенная разница заключается в том, что при плазменной обработке реакции происходят в газовой фазе и промежуточным продуктом является очень мелкий порошок, обладающий высокой реакционной способностью. Как показывает опыт, растворимые компоненты очень быстро растворяются, а нерастворимые легко отделяются путем фильтрации. Хотя диаметр образующихся частиц очень мал (составляет всего 0,035 - 0,050 мкм), они не образуют шлама. Некоторые окислы, (полученные таким путем, обладают аномальной растворимостью в некоторых растворителях, что можно объяснить высокой степенью разрушения и неупорядоченной структурой их решетки.
Получение двуокиси циркония путем термического разложения цирконового песка. Фирма Ionarc Smelter Ltd ввела в 1970 г. в эксплуатацию полупромышленную установку для получения двуокиси циркония и силиката натрия из цирконового песка.
Двуокись циркония обычно получают путем переплава больших порций цирконового песка в мощных трехфазных дуговых печах с углеродистыми электродами. При этом двуокись кремния, которая имеет более низкую температуру кипения, чем двуокись циркония, выпаривается и отгоняется. После охлаждения оставшегося материала получают зерна двуокиси циркония с непостоянными свойствами, особенно в центре зерен, где охлаждение происходит медленнее. Образовавшиеся кристаллиты довольно крупные. Оставшиеся примеси склонны концентрироваться в различных местах зерен. Однако перед дроблением очищается только наружная поверхность зерен (причем но усмотрению обслуживающего персонала). При этом полученный материал смешивают, в результате чего образуется более или менее однородный конечный продукт, но не столь однородный как двуокись циркония, полученная путем плазменной обработки. при которой тепло воздействует абсолютно равномерно на пренебрежимо малые отдельные шаровидные частицы исходного материала.
Основное место в технологии плазменных процессов занимает промышленная плазменная печь фирмы Ionaro. Это универсальная установка, служащая для ряда высокотемпературных операций обработки, при которых частицы материала проходят через плазму, имеющую температуру около 20000 К.
Цирконовый песок загружается в верхнюю часть вертикальной печи со скоростью около 180 кг/ч, здесь он проходит через горячую зону диаметром примерно 127, длиной 910 мм. В каждый данный момент в печи находится 1 кг перерабатываемого материала.
Стены печи охлаждаются водой и не имеют огнеупорной футеровки. Отношение величины поверхности горячей зоны к ее объему мало, что снижает тепловые потери и позволяет расплавить загруженный материал в течение долей секунды.
Расход энергии составляет всего 1,32 кВт·ч/кг по сравнению с 9,9 кВт·ч/кг в нормальных печах для возгонки. В отличие от этих печей, работающих по принципу отгонки, плазменные печи характеризуются большой скоростью прохождения материала, непрерывным режимом работы и гораздо более низкими капитальными затратами.
По существу вся образующаяся при сепарации двуокись кремния остается в печи в твердом состоянии. Это предотвращает загрязнение атмосферы вследствие уноса двуокиси кремния, что обычно наблюдается при переплаве цирконовых песков. Материал, выходящий из печи, представляет собой сепарированный цирконовый песок, в котором отдельные частицы уже состоят не из силиката циркония, а из смеси двуокиси циркония и двуокиси кремния. В связи с очень высокими температурами в плазменной печи и последующим быстрым охлаждением это разложение исходного материала на два окисла является практически полным. Порядок дальнейшей переработки показан на рис. 55.
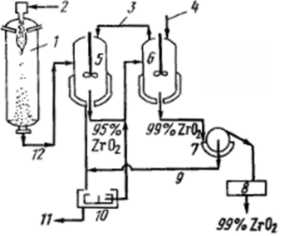
1 - плазменная печь; 2 - цирконовый песок; 3 - использованная NaOH; 4 - водный раствор гидроокиси натрия: 5 - первый этап выщелачивания; 6 - второй этап выщелачивания; 7 - мойка; 8 - сушилка; 9 - отфильтрованная вода; 10 - центрифуга; 11 - осветленный раствор силиката натрия; 12 - разложенный цирконий
Рисунок 55. Схема переработки цирконового песка в низкотемпературной плазме
Получаемая на плазменных установках двуокись кремния аморфна, при этом она обладает высокой реакционной способностью. Аморфную двуокись кремния можно легко экстрагировать от пренебрежимо малых кристаллитов двуокиси циркония, с которыми она смешана. Для отделения достаточен 50%-ный раствор гидроокиси натрия с температурой кипения 258°С. Экстрагирование осуществляется в две стадии. На первой стадии материал, полученный в плазменной печи, реагирует с частично использованной на второй стадии экстрагирования гидроокисью натрия, в результате чего из смеси удаляется большая часть имеющейся двуокиси кремния. Одновременно частично использованная гидроокись натрия нейтрализуется с получением силиката натрия по реакции:
ZrO 2 + SiO 2 + 2NaOH = Na 2 SiO 3 + ZrO 2 + H 2 O
Более легкую жидкость высокой вязкости отливают из сосуда, в котором проводилось экстрагирование, разбавляют водой и центрифугируют, чтобы обеспечить отмучивание раствора. Путем выпаривания избыточной воды затем получают пентагидрат. Твердые фракции, полученные на первой стадии экстрагирования, которые содержат примерно 95% двуокиси циркония, на второй стадии реагируют со свежим кипящим 50%-ным раствором гидроокиси натрия. На этой стадии экстрагирования получают двуокись циркония чистотой более 99% в виде пористых шаровидных частиц, величина которых в большинстве случаев не превышает 0,2 мм. Этот материал промывают в ротационном вакуум - фильтре; воду от промывки используют для разбавления вязкого раствора силиката натрия. Оставшиеся влажные твердые вещества сушат до остаточного содержания влаги менее 1%.
В зависимости от требований потребителей процесс можно сократить и разделенный в плазменной печи материал подвергать только одному экстрагированию или вообще отказаться от него. В ходе процесса получают три конечных продукта, отличающихся один от другого, прежде всего содержанием двуокиси кремния. Типичный химический состав этих трех продуктов приведен в таблице 12. Продукты чистотой 95 и 99% состоят из хрупких пористых шаровидных частиц; материал чистотой 70% имеет форму твердых стекловидных шариков. Для всех трех продуктов 95% частиц имеют размеры в проделах 0,2 - 0,04 мм.
Таблица 12 - Типичный состав трех получаемых видов ZrО 2
Полученная в плазменной печи двуокись циркония резко отличается от получаемой обычным способом, как величиной кристаллитов, так и морфологией, а также стабильностью свойств. Кристаллиты очень однородны, диаметр их колеблется лишь в пределах 0,1 - 0,2 мкм. Выпускаемый фирмой lonarc продукт состоит из пористых частиц диаметром до 300 мкм, которые легко поддаются дроблению до любой требуемой крупности. В связи с очень малыми размерами исходных кристаллитов при дроблении до крупности менее 0,04 мм тоже получают пористые частицы.
Преимущества процесса. По сравнению с другими процессами этот плазменный процесс имеет важные преимущества, обусловленные тем, что отсутствует необходимость в растворении исходного цирконового материала. При типичном способе производства высококачественной двуокиси циркония по классической технологии (т. е. комбинации термической обработки с химической реакцией) получают богатый цирконием раствор, из которого нужно выделить цирконий (обычно ионами сульфата). Выпавший осадок нужно промыть и подвергнуть обжигу, чтобы получить двуокись циркония. При этом способе материал нужно нагревать до высокой температуры и удалять образующийся сернистый ангидрид. В конечном продукте остается определенная переменная доля ионов сульфата.
В противоположность этому на плазменной установке двуокись циркония получается уже при прохождении исходного материала через плазму. Единственной дальнейшей операцией является удаление двуокиси кремния путем экстрагирования. При этом степень чистоты конечного продукта можно регулировать в зависимости от требований потребителя. Следующими преимуществами являются высокое качество и постоянство размеров кристаллитов даже в случае применения в шихте исходного материала разного качества.
Плазменная технология имеет и другие преимущества, например меньшее загрязнение окружающей среды. При получении двуокиси циркония из исходного материала уноса двуокиси кремния не происходит. Кроме того, при этом процессе по существу не образуются отходы, так как все используемые для процесса материалы, в конце концов, превращаются в полезный продукт. Далее в качестве побочного продукта получают силикат натрия, который можно использовать при производстве поверхностно - активных веществ.
Экономические данные. Затраты на производство двуокиси циркония по способу Ионарк колеблются в зависимости от объема производства. При производстве опытных партий в количестве несколько более 45 т двуокиси циркония чистотой более 99% в год с целью проверки спроса на рынке соотношение между производственными расходами и рыночными ценами было не очень благоприятным. Однако можно предположить, что после сооружения и ввода в эксплуатацию промышленной установки экономичность этого процесса значительно возрастет. По данным фирмы IonarcJ при повышении производства в пять раз можно сэкономить 40% расходов по переделу.
Десиликация каолина путем термического воздействия низкотемпературной плазмы. Весьма перспективной является возможность десиликации некоторых соединений при высоких температурах плазмы. В Горнометаллургическом институте г. Остравы был успешно проведен опыт по десиликации каолина с целью проверки теоретической возможности использования этого материала для получения алюминия. Опыт проводили следующим образом: смесь каолина и древесного угля отвердили органическим связующим и подвергли воздействию плазмы, полученной из аргона и азота в соотношении объемов 1:1, при температуре плазмы около 18 000 К. Использованный каолин содержал 52% двуокиси кремния. В условиях высокой температуры вследствие воздействия плазмы указанного состава протекали следующие процессы:
Восстановление Аl 2 O 3 углеродом
2 / 3 Al 2 O 3 + 2C = 4 / 3 Al + 2CO (119)
Образование нитридов AlN
Аl 2 O 3 + 3С + N 2 = 2AlN + 3СО (120)
Однако эта реакция образования AlN при высоких температурах подавлялась вследствие образования карбидов по реакции
4Аl + 3С = Al 4 C 3 (121)
Одновременно с этими протекал и ряд других реакций, в основном с образованием алюминия, кремния и более простых окислов. Во время опыта было установлено, что Аl 2 O 3 испаряется и распадается. Одновременно образовывался и газообразный субокисел Аl 2 О, который стекал и оседал на холодных участках реакционного сосуда. Присутствовавшая в системе двуокись кремнии легче восстанавливалась, чем А1 2 О 3 . Нитриды кремния тоже образовывались легче, чем нитриды алюминия. При одновременном восстановлении Al 2 O 3 и SiO 2 образовывались и такие продукты, как Si, SiO, SiC, которые оказывали влияние на дальнейший ход процесса.
Образующиеся, промежуточные нитриды характеризуются более низкой термодинамической стабильностью, чем одновременно существующие карбиды, вследствие чего они взаимодействуют с углеродом с образованием карбидов или карбонитридов и выделением газообразного азота.
2AlN + 3/2C=1/2Al 4 C 3 + N 2 (122)
1/2Si 3 N 4 + 3/2C = 3/2SiC + N 2 (123)
Для реакций справедливо следующее: при комнатной температуре термодинамическая стабильность нитридов выше, чем карбидов. При более высоких температурах - около 1700°С для AlN и 1500 - 1600°С для Si 3 N 4 - наблюдается обратное явление. Кроме указанных реакций, следует учесть и образование карбонитридов.
В ходе опыта шихта, помещенная в графитовый сосуд, быстро расплавилась и стала испаряться. Реакции протекали как в жидкой, так и в газовой фазе. При соответствующих температурных условиях происходило только селективное выпаривание образующегося карбида алюминия, причем сублимат осаждался на холодных участках плазменного реактора. Карбид кремния с высокой температурой плавления остался в графитовом сосуде. После химической обработки сублимата с получением Аl 2 O 3 была проведена оценка результатов химического анализа. Содержание SiO 2 составило 5,3% (по массе), т. е. десятую долю первоначального содержания в исходном материале. Можно предположить, что если будет найден оптимальный режим процесса, то после многократного повторения можно будет получить и из материала с высоким содержанием двуокиси кремния глинозем такой чистоты, что он будет пригоден для получения алюминии, например электролизом. Однако эксперимент в связи с высокими затратами и дефицитом природного боксита имеет лишь демонстрационное значение.
1. На чем основано получение веществ термоспособом.
2. Процессы и технология разложения цирконового песка.
3. Процессы и технология десиликации каолина.
Литература
1. Крапивина С.А. Основы плазмохимии. Л.: ЛТИ, 1976, - 65е.
2. Моссэ А.Л., Печковский В.В. Применение низкотемпературной плазмы в технологии неорганических веществ. Минск: Наука и техника, 1973.- 213с.
В связи с определяющим влиянием на параметры процесса горения термического разложения твердых материалов рассмотрим основные его закономерности. При повышении температуры твердого вещества происходит разрыв химических связей с образованием более простых компонентов (твердых, жидких и газообразных). Термическое разложение или пиролиз представляет собой особый класс химических реакций, кинетика которых описывается уравнением Аррениуса, согласно которому скорость реакции экспоненциально возрастает с увеличением температуры. При термическом разложении, как правило, одновременно протекает большое количество последовательно-параллельных реакций, и поэтому величина энергии активизации, определенная по опытным данным, характеризует некоторый усредненный процесс. Для большинства веществ ее значение изменяется в пределах 140-250 кДж/моль.
Термическое разложение является чрезвычайно сложным процессом, зависящим от множества параметров. Различают изотермический и неизотермический пиролиз. В первом случае температура образца постоянна и во время всего периода разложения не меняется. При неизотермическом пиролизе температура может меняться как во времени, так и по глубине образца. При горении имеет место неизотермический пиролиз твердой фазы.
Многочисленные исследования, проведенные для большого количества веществ, показывают, что закономерности разложения существенно зависят не только от вида горючего, но и от температуры пиролиза, скорости ее изменения во времени, размеров пиролизуемого образца, его формы, степени распада и т. д. Процесс пиролиза существенно зависит от того, находится ли образец в контакте с продуктами разложения или последние удаляются из реакционного сосуда.
В качестве примера схематично приведено разложение наиболее распространенного горючего материала - древесины. Древесина, как известно, представляет собой смесь большого количества веществ различного строения и свойства. Основными ее компонентами являются гемицеллюлоза, целлюлоза и лигнин.
Целлюлоза является высокомолекулярным полисахаридом с эмпирической формулой (С 6 Н 10 О 5)m. Молекулярный вес целлюлозы составляет свыше 1 500000.
Гемицеллюлозы представляют собой смесь пентозанов (С 5 Н 8 О 4), гексозанов (С 6 Н 10 О 5) и полиуронидов. В хвойной древесине пентозаны и гексозаны содержатся почти в равных количествах, в лиственной древесине гемицеллюлозы состоят почти целиком из пентозанов.
Лигнин является наименее изученным в химическом отношении компонентом древесины. Полагают, что лигнин имеет ароматическую природу и содержит связанные с ароматическим веществом углеводы. Элементный состав лигнина значительно колеблется. В соответствии с этим неодинаковы и эмпирические формулы лигнина, предложенные различными авторами: (С 10 Н 10 О 3)n, (С 22 Н 20 О 7)n, (С 120 Н 138 О 35)n. Молекулярный вес лигнина достигает нескольких тысяч. В зависимости от породы, возраста, места произрастания соотношение этих компонентов может быть различным, однако в среднем древесина состоит из 25% гемицеллюлозы, 50% целлюлозы и 25% лигнина. Древесина содержит ~ 50% углерода, ~ 6% водорода и ~ 44% кислорода. Это пористое вещество, объем пор составляет 50-75% ее объема. Вещества, входящие в состав древесины, обладают различным строением и неодинаковой термической стойкостью. Наименее термоустойчивы - гемицеллюлозы, наибольшей термической стойкостью обладает лигнин. Так, если "начало интенсивного разложения целлюлозы соответствует температуре 285°С, лигнин интенсивно разлагается лишь при достижении температуры 350-450°С. Большая термическая устойчивость лигнина объясняется его химическим строением. Как известно, ароматические соединения являются более термостойкими, чем гетероциклические, к которым принадлежат гемицеллюлозы и целлюлоза. Поэтому породы древесины, имеющие повышенное содержание гемицеллюлозы, способны к более легкому воспламенению.
Рассмотрим разложение древесины, предельно упростив процесс, полагая, что температура всей массы образца будет возрастать квазистационарно. Можно условно выделить несколько характерных этапов пиролиза древесины.
При нагревании до температуры 120-150°С завершается процесс сушки древесины, т. е. выделение физической воды.
При дальнейшем нагревании до температуры 150-180°С происходит выделение внутрикапиллярной и химически связанной влаги, разложение наименее термически стойких компонентов древесины (луминовые кислоты) в основном с выделением двуокиси углерода и воды.
При температуре 250°С происходит пиролиз древесины (в основном гемицеллюлозы) с выделением таких газов, как СО, СН 4 , H 2 , СО 2 , Н 2 О и т. д. Образующаяся газовая смесь уже способна к воспламенению от источника зажигания. По аналогии с жидкостью эту температуру можно принять за температуру вспышки древесины. При температуре 280-300°С начинается интенсивное разложение древесины.
При температурах 350-450°С происходит интенсивный пиролиз древесины и выделяется основная масса горючих газов - 40% от максимально возможного количества. Выделяющаяся в этой области пиролиза газообразная смесь состоит из 25% H 2 и 40% предельных и ненасыщенных углеводородов. Наиболее характерной особенностью этой температурной области является ее экзотермичность. Здесь протекают интенсивные химические реакции между продуктами первичного разложения - кислотами, альдегидами и т. п., сопровождающиеся выделением тепла. В литературе приводятся данные, согласно которым количество выделяющегося здесь тепла составляет 5-6% от низшей теплоты сгорания древесины. В среднем для древесины она равна 15000 кДж/кг. Таким образом, тепловой эффект экзотермических реакций пиролиза равен 750-900 кДж/кг.
Следует иметь в виду, что эти результаты получены при медленном термическом распаде древесины в течение 8ч. Чем медленнее происходит пиролиз, тем больше экзотермичность процесса разложения. Так, если длительность пиролиза увеличить до 14 суток, тепловой эффект возрастает до 7,5% от низшей теплоты горения. Напротив, при быстром нагреве образца древесины от начальной температуры до температуры завершения термического распада (550-600°С) экзотермичность процесса резко снижается, поскольку уменьшается возможность для протекания вторичных экзотермических реакций между продуктами первичного распада с образованием двуокиси углерода и воды. Подтверждением сказанному могут служить результаты пиролиза древесины в вакууме, когда роль вторичных реакций между активными продуктами первичного распада сведена к минимуму. Так, при снижении давления до 5 мм.рт.ст. экзотермический эффект пиролиза березовой древесины снизится до 2,5% от низшей теплоты сгорания. Согласно последним исследованиям, положительный наибольший тепловой эффект сопровождает разложение лигнина.
При температурах 500-550°С скорость термического разложения древесины резко снижается. Выход летучих практически прекращается, поскольку разложение образца в основном заканчивается при более низких температурах. При температуре 600°С разложение древесины на газообразные продукты и углистый остаток завершается.
Изменение скорости нагрева образца древесины от начальной температуры до температуры завершения пиролиза приводит к качественному и количественному смещению характерных стадий пиролиза. Медленный нагрев приводит к смещению температурных границ стадий пиролиза в область более низких значений, наоборот, повышение скорости нагрева - в область более высоких значений.
Аналогично древесине будет протекать пиролиз каменного угля и торфа, однако максимальные скорости выхода летучих продуктов у них будут иметь место при соответственно других температурах. Каменный уголь состоит из более термостойких углеродосодержащих компонентов, и разложение его протекает менее интенсивно и при более высоких температурах, чем древесины и торфа.
Термическое разложение исходных соединений
Элементы тепловой теории гашения пламени
Вопрос 1. Предельные параметры процессов горения.
Тема № 9. Основные представления тепловой теории гашения пламени.
РАЗДЕЛ IV. Предотвращение и прекращение процессов горения.
ʼʼПредвидеть, значит управлятьʼʼ
Блез Паскаль
Лекция № 17. Вопросы:
1. Предельные параметры процессов горения. Элементы тепловой теории гашения пламени
2. Гашение пламени в узких каналах. Огнепреградители.
Теоретическое значение температуры пламени составляет 2000-3000 К. При горении в условиях пожара за счёт потерь теплоты на излучение зоны горения и химического недожога температура пламени редко превышает 1700-1800 К. Температура зоны горения в условиях пожара в значительной степени зависит от вида горючего материала, его агрегатного состояния и условий тепло- и массообмена. По этой причине можно условно принять, что верхние температурные пределы на пожаре лежат в интервале при горении: горючих газов 1600 - 1800 К
жидкостей 1500 - 1600 К
твердых горючих материалов 1400 - 1500 К
Важно заметить, что для специалистов пожарной охраны с точки зрения прекращения горения наибольший интерес представляет нижний температурный предел. Ориентировочно его можно оценить по теплоте горения.
Нижний предел теплоты горения большинства углеводородо - воздушных смесей Q H (min) = 1830 кДж/м. С учетом тепловых потерь излучением (около 20 %) на нагрев продуктов горения остается примерно 1460 кДж/м 3 .
Учитывая, что из 1 м горючей смеси образуется примерно 1 м продуктов горения, приведенного к нормальным условиям, и что средняя теплоемкость продуктов горения в интервале температур от 100 до 1000 °С примерно
равна 1,45 кДж/м -град, получим: С>пред - AQ
Т ГО р(пред) =.................................. - -------------- ʼʼ 1000 °С. (8.1)
£V nr - с р 1,45
Ниже этой температуры пламенное горение в большинстве случаев становится невозможным, пламя гаснет и процесс горения прекращается.
Количество теплоты, выделяющейся при горении во фронте пламени, равно:
q + = Q p - V ‣‣‣ w = Q p ‣‣‣ V ‣‣‣ ko-c r -c OK -exp(- E/RT), (8.2)
где Q p - тепловой эффект реакции горения.
Теплота͵ выделяемая в зоне горения, расходуется на излучение и конвекцию, ᴛ.ᴇ. для суммарного теплоотвода с единицы поверхности зоны горения можно записать:
Ч_ = Яи + Яконв= в-а(Т г 4 - Т 0 4) + а(Т г - Т 0), (8.3)
где в - степень черноты факела пламени: а - постоянная Стефана-Больцмана; а - коэффициент теплоотдачи;
Т г и Т 0 - соответственно, температура горения и окружающей среды, К.
Графически, как функции температуры, выражения (8.2) и (8.3) имеют вид, представленный на рис.8.1.
Здесь нижняя ветвь кривой тепловыделения q+ представляет собой экспоненту. Функция теплоотвода q_ представляет собой кривую линию. В случае если менять условия горения, к примеру, температуру окружающей среды Т 0 , то она будет перемещаться параллельно самой себе.
Анализ данного графика раскрывает основное содержание и физико- химический смысл тепловой теории гашения пламени. Отрезок АС кривой тепловыделения соответствует устойчивому состоянию горючей газо- паровоздушной смеси, когда реакции горения отсутствуют.
После воспламенения газов и паров пламя практически мгновенно переходит в точку Г на графике, температура которой соответствует температуре горения Т г в зоне реакции. Эта точка устойчивого состояния пламени, характеризующегося динамическим тепловым равновесием: тепловыделение равно теплоотводу.
В случае если снизить или повысить температуру путем кратковременного воздействия, пламя возвратится в точку Г, и горючее вещество будет гореть до полного выгорания.
Но пламя по-иному поведет себя, в случае если каким-нибудь способом понижать температуру в зоне горения. В этом случае кривая теплопотерь q_ будет перемешаться влево от точки Г, и пламя придет в точку П. Здесь пламя также будет находиться в равновесии, но оно уже будет неустойчивым. Чуть понизить температуру еще - пламя тут же возвращается на отрезок АС, ᴛ.ᴇ. гаснет. Следовательно точка П соответствует критическому режиму горения. Температура пламени в точке П принято называть температурой гашения, Т гаш.
Количественно тепловая теория гашения пламени базируется на основном представлении о том, что процесс горения протекает в довольно узком характеристическом интервале температуры:
е = (RT r 2)/E (8.4)
где Т г - адиабатическая температура горения, К.
Для кинетического режима горения температура гашения будет равна: Т гаш кин = Т г - 0. (8.5)
В таком случае, к примеру, для углеводородов, у которых Т г = 2400 К, Е = 130 кДж/моль, R = 8,3 Дж/моль, температура гашения пламени будет равна:
Т гаш кин 0 = 2400 - (8,31- 2400 2)/(130-10 3) ʼʼ 2000 К, (8.6)
то есть 0 ʼʼ 400 К.
неполного горения (оксида углерода, сажи, копоти, смол и др.), протекают во фронте пламени;
‣‣‣ диссоциация продуктов горения;
‣‣‣ ионизация.
На процесс термического разложения влияют, в первую очередь, температура и продолжительность нагревания. Существенную роль может играть поверхность приемника тили трубки: железо и никель ускоряют процесс разложения путем инициирования гетерогенных реакций на поверхности. Стекло, кварц, хром и высокохромированные стали не обладают таким поверхностным каталитическим действием. Чем выше температура и ниже давление, тем сильнее возрастает выход газообразных продуктов. Экспериментально установлено, что процессы разложения органических соединений протекают за время порядка 0.001 секунды. На начальных стадиях обычно рвутся химические связи с наименьшей энергией разрыва. Энергия разрыва С-С-связи в парафиновых углеводородах уменьшается в следующем порядке:
СН 3 -СН 2 > СН 2 -СН 2 > СН -СНз > СН- СН 2 > СН- сн По увеличению термической стабильности углеводороды можно расположить в следующий ряд:
н-парафины < разветвленные парафины < циклопарафины < ароматические < < полициклические ароматические.
С ростом молекулярной массы термическая стойкость углеводородов падает. Парафины с двумя или несколькими углерода в молекуле начинают заметно разлагаться уже при температуре 400 - 600 °С.
При термическом разложении углеводородов протекают многочисленные сопутствующие реакции, в результате которых образуются этан, этилен, ацетилен. К примеру, при крекинге метана может реализоваться ʼʼцепочкаʼʼ:
2СН4 С 2 Н 6 -> С 2 Н4 -> С 2 Н 2 2С + Н 2
Для диффузионного режима горения теория дает температуру гашения пламени ниже на 39, ᴛ.ᴇ. :
Т гаш диф =Т Г -30. (8.7)
Температурный интервал кинетического горения углеводородов узкий, всего около 400 К, а фактическая температура в зоне горения близка к адиабатической, ᴛ.ᴇ. к ее верхнему пределу.
Температурный интервал существования диффузионного пламени очень широкий, до 1100 К, а фактическая температура в зоне горения ближе к температуре гашения.
При этом и кинетическое и диффузионное пламя можно погасить охлаждением зоны горения всего на 100-300 К.
Необходимо отметить, что приведенные вычисления носят ориентировочный характер, величины указанных температур будут, естественно, различаться у разных углеводородов и, конечно же, будут ниже у веществ, содержащих кроме С и Н гетероатомы: О, S, N и пр.
| снизить Т |
| о |
снизить концен- снизить к 0 повысить а трации С г и С 0К и повысить е из зоны горения
разбавить горю- ввести в чую смесь него- зону горе-
повысить коэфф. черноты зоны
Термическое разложение исходных соединений - понятие и виды. Классификация и особенности категории "Термическое разложение исходных соединений" 2014, 2015.
Термическое разложение (пиролиз) древесины - это разложение древесины без доступа воздуха под действием высокой температуры. В результате этого процесса получаются твердые, жидкие и газообразные продукты. Твердые продукты остаются в виде древесного угля в аппарате, в котором ведется пиролиз, а жидкие и газообразные продукты выделяются совместно в виде парогазовой смеси (см. главу 3). Парогазовую смесь разделяют путем охлаждения на конденсат (жижку) и неконденсирующиеся газы. Жижку перерабатывают на уксусную кислоту, метиловый спирт, смолу и другие продукты (см. главы 4-6), а неконденсирующиеся газы сжигают как топливо.
Пиролиз древесины. Процесс разложения древесины при пиролизе можно подразделить на четыре стадии: 1) сушку; 2) начало разложения; 3) образование, испарение и возгонку основного количества продуктов разложения древесины, протекающие при 270-450 °С с бурным выделением тепла (экзотермический процесс); 4) прокаливание угля до конечной температуры обычно не выше 550-600 °С и удаление остатков летучих веществ. Кроме третьей стадии, все стадии процесса требуют подвода тепла извне.
Тепловой эффект процесса термораспада древесины зависит от условий проведения пиролиза и мало зависит от типа и конструкции аппарата. Величина низшего теплового эффекта составляет 1000-1250 кДж/кг, или 5-6 % от теплоты сгорания исходной древесины.
В аппаратах периодического действия стадии процесса протекают последовательно во времени, тогда как в непрерывно - действующем аппарате (рис. 2.11) в одно и то же время в верхней зоне происходит сушка, ниже - нагревание древесины до температуры экзотермической реакции, в средней зоне - разложение древесины и прокаливание угля и в нижней - охлаждение угля перед выгрузкой. Поэтому при работе периодически действующего аппарата состав парогазовой смеси по ходу процесса изменяется, а при непрерывном процессе остается во времени практически постоянным.
Первым из компонентов древесины, уже при температуре несколько ниже 150 °С, начинает распадаться ксилан, но в основном его распад идет при 250-260 °С с образованием фурфурола, уксусной кислоты и газов. Распад лигнина начинается
Рис. 2.11. Схема пиролиза древесины в непре - рывнодействующем аппарате:
1 - зона сушки; 2 - зона нагревания до температуры экзотермической реакции; 3 - зона пиролиза и прокалки угля; 4 - промежуточная зона; 5 - зона охлаждения угля
При температуре около 200 °С; этот процесс вследствие гетеро - и гемолитической диссоциации химических связей между структурными единицами лигнина и внутри их приводит к образованию низкомолекулярных летучих соединений и полной перестройке первичной структуры лигнина. Процесс деполимеризации целлюлозы протекает при температуре выше 300 °С. Как целлюлоза, так и лигнин при пиролизе дают уголь, газы и смолу. Однако из целлюлозы выход угля равен 35%, а из лигнина- около 50%. Газы, полученные при разложении лигнина, содержат около 50 % СО, 35-40 % СН4 и лишь немного С02, тогда как целлюлоза дает низкокалорийный газ, содержащий более 60 % СОг. Образование метана (СН4) происходит в основном за счет метоксильных групп лигнина.
Ароматические соединения, содержащиеся в древесных смолах (фенолы и др.), образуются при термическом разложении лигнина, алифатические соединения - в основном из целлюлозы и других полисахаридов.
Уксусная кислота получается из целлюлозы в количестве 2-3 %, из лигнина - около 1 %. Основным ее источником являются ацетильные группы древесины, содержание которых больше в древесине лиственных пород, поэтому выход уксусной кислоты из пород лиственной древесины выше, чем из хвойной. Древесина лиственных пород особенно береза и бук, предпочтительна для пиролиза, так как из нее получают более хороший уголь.
Метиловый спирт образуется в основном из метоксильных групп метилглюкуроновой кислоты, входящей в состав гемицел - люлоз. Немного метилового спирта образуется из лигнина.
Фурфурол целиком получается в результате деструкции пентозанов и дегидратации образующихся при этом пентоз. Если древесину перед пиролизом пропитать разбавленной серной кислотой, то выход фурфурола в несколько раз увеличится.
Проводя термическое разложение древесины с одновременным ее окислением, например путем обработки в водной среде
/ - зона подсушки (150-300 °С); 2 - зона пиролиза (300-900 °С); 3 - зона восстановления (900-1100 °С); 4 - зона горения (1100-1300 °С); 5 - зольник
Рис. 2.13. Схема обратного процесса газификации древесины:
1 -зона подсушки: 2 ~ зона пиролиза; 3 - зона горения; 4 - зона восстановления; 5 - зольннк
Кислородом под давлением и при высокой температуре, можно> получить из нее уксусную кислоту с выходом около 15 %„ а также муравьиную кислоту.
Газификация древесины. К области термического разложения древесины относится также и ее газификация, т. е. безостаточное (если не считать золы) разложение древесины в газогенераторах. Различают два основных процесса газификации- прямой и обратный. При прямом процессе (рис. 2.12) поток газов направлен снизу вверх, воздух вводится ниже колосниковой решетки (на которой располагается древесное сырье - поленья, чурки или щепа), а образовавшийся генераторный газ отводится сверху. При обратном (обращенном) процессе (рис. 2.13) движение газов происходит сверху вниз, возДух подводится немного выше колосниковой решетки, а генераторный газ отводится снизу.
Основная горючая часть генераторного газа - окись углерода образуется при неполном окислении раскаленного угля кислородом воздуха:
2С + Оа = 2СО +246,4 кДж.
Воздух подается в в ограниченном количестве, иначе уголь полностью сгорит до С02. Вместе с воздухом можно вводить водяной пар; он реагирует с раскаленным углем, образуя окись углерода и водород, что повышает калорийность газа.
Сырой газ, получаемый при прямом процессе, содержит древесную смолу и уксусную кислоту, которые могут быть выделены в процессе очистки газа. При обращенном процессе в газе очень мало лесохимических продуктов, очищенный газ ранее применялся взамен бензина в лесовозных автомобилях, для чего на них устанавливали небольшие с упрощенной системой очистки газа.
В связи с ростом цен на нефтяное топливо в некоторых странах возобновился интерес к газификации древесины с целью получения газа для отопления жилищ и для других целей. Ведутся также работы по каталитическому ожижению древесины для получения нефтеподобных продуктов.